Mocht u onze informatie op kanker-actueel waarderen dan wilt u ons misschien steunen met een donatie?
Zie ook ervaringsverhalen van andere patienten met een hersentumor. En/of ervaringsverhalen op video
1 december 2018: lees ook dit artikel:
26 november 2018: Zie ook dit artikel over larotrectinib bij solide tumoren met TRK pos. mutatie
26 november 2018: Bron: British Journal of Cancervolume 119, pages693–696 (2018)
Hersentumoren van het type Glioblastoma zijn heel moeilijk te behandelen. Maar meer en meer blijken ook deze tumoren soms toch wel te behandelen met langere overall overleving dan statistisch wordt voorspeld.
Hier een case studie van een drie jarig meisje met een hersentumor van het type glioblastoma. Wat het bijzonder maakt is dat de expressie van de tumor van dit meisje een relatief zeldzaam voorkomende mutatie, de ETV6–NTRK3 mutatie liet zien. Hoewel bij kinderen met een hersentumor deze mutatie relatief vaker wordt geconstateerd dan bij volwassenen. Al komt dat misschien ook omdat er nog weinig getest wordt op deze specifieke mutatie. Maar is een bijzonder verhaal.
Na falen van de standaardbehandelingen werd met meisje alsnog behandeld met het medicijn larotrectinib een zogeheten TRK medicijn (TRK = neurotrophin receptor kinases) dat uitstekende resultaten laat zien bij solide tumoren met die specifieke mutatie.
Ook bij het meisje werkte dit medicijn zeer goed. Heel snel verminderden de tumoren in omvang en aantal en al snel was ze nagenoeg in complete remissie. Bij het opmaken van dit studierapport was ze dat al 9 maanden.
Larotrectinib is de eerste zogeheten pan-TRK-remmer in die onderzocht wordt in studieverband. Recente Fase 1-resultaten toonden aan dat larotrectinib goed wordt verdragen door kinderen, met zeer hoge responspercentages in solide tumoren die een TRK-mutatie / expressie hebben.10
Omgekeerd reageerden solide tumoren en HGG zonder TRK-fusies niet op dit medicijn.11
Een verkorte omschrijving van een case studie bij een drie jarig meisje met een hersentumor.
De patiënt is een 3-jarig meisje dat op 5-jarige leeftijd de diagnose van een hersentumor had. Ze presenteerde aanvankelijk braken en epileptische aanvallen en een MRI toonde een heterogene massa van 6 × 3 × 2 cm in de rechter laterale ventrikel. De tumor kon wel worden geopereerd wat ook bij dit miesje werd gedaan
Uit het pathologisch rapport bleek ze een hersentumor hooggradig (HGG) te hebben en werd post operatief behandeld met een standaard behandelprotocol voor een hersentumor bij kinderen met 13 cycli van chemotherapie.5
Vier maanden nadat de behandeling was voltooid kreeg het meisje een recidief / ziekteprogressie met meerdere knobbeltjes in de laterale en derde ventrikels. Verder tumor debulking bevestigde een recidief van een hersentumor hooggradig (HGG).
Na 6 maanden werd een nieuwe tumor voorzichtig zoveel mogelijk weggehaald en nabehandeld door een kuur van gerichte bestraling met 54 Gy in het tumorgebied. Het weggehaalde tumorweefsel werd gemeten op mutaties en receptoren expressie en getoetst aan personaliseerde medicijnen.
Drie maanden na het voltooien van de bestraling had het kind moeite met lopen, slaperigheid, overgeven en prikkelbaarheid. Een MRI toonde wijdverspreide progressieve ziekte met verhoogde activiteit in het operatiegebied. En vergroting van suprasellaire en subependymale knobbeltjes in de laterale en derde ventrikels. Dexamethason werd voortgezet met 1,5 mg per dag. De ouders kregen te horen dat ze ongeneeslijk was en ze werd doorverwezen naar palliatieve zorg voor symptoombestrijding.
Omdat een receptoren- en mutatieonderzoek liet zien dat het meisje de specifieke ETV6–NTRK3 mutatie/expressie had werd op basis van 'compassionate use' een behandeling gestart met larotrectinib. (tekst gaat verder onder grafiek)
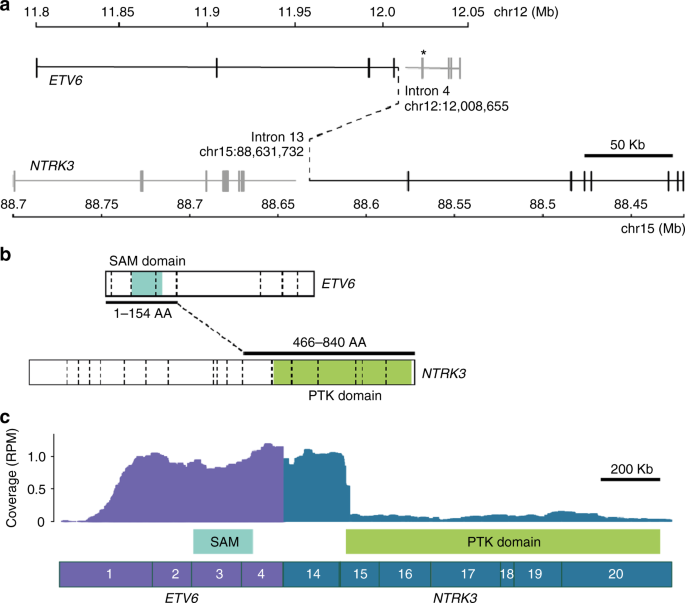
ETV6–NTRK3 fusion. a Whole-genome sequencing revealed a t(12;15)(p13.2;q25.3) translocation, resulting in an in-frame ETV6–NTRK3 fusion, denoted by black solid and dashed lines. The ETV6-breakpoint differs from the common ETV6-RUNX1 translocation hotspot, which is indicated (*). b The first 154 ETV6, and last 374 NTRK3 amino acids (AA) are fused, retaining ETV6′s sterile alpha motif (SAM) domain, as well as NTRK3′s protein tyrosine kinase (PTK) domain. Exon–exon boundaries are indicated with dashed vertical lines. c RNA-Seq confirmed the expression of the ETV6–NTRK3 fusion, with 62 sequencing reads supporting the breakpoint junction. Exons are numbered. RPM: reads per million mapped reads. ETV6 (NM_001987) and NTRK3 (NM_001012338) isoforms used in all figures
En al na 4 weken had ze geen verdere lusteloosheid, slaperigheid, hoofdpijn of overgeven, at weer goed, begon ook duidelijker te praten en had geen dexamethason meer nodig. Na 6 weken kon ze zelfstandig lopen, sprak ze in 2-3 woorden en had ze normale energieniveaus. Tegen week 8 was ze aan het rennen, aan het dansen en bleef ze nieuwe woorden en taal te gebruiken. Er werden geen bijwerkingen waargenomen die aan larotrectinib konden worden toegeschreven.
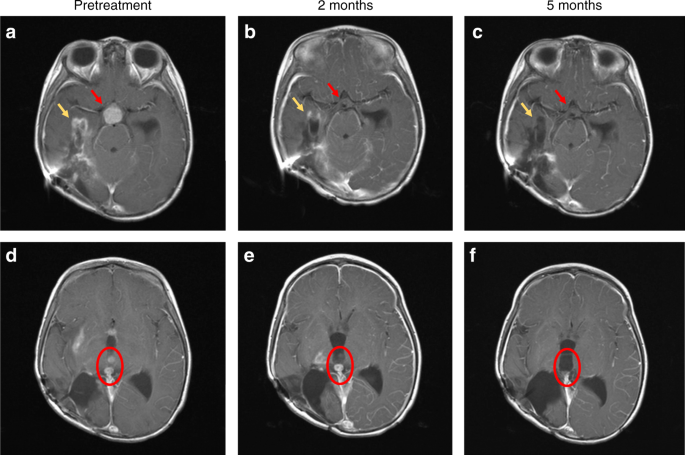
Een MRI bevestigde dat de tumoren sterk waren verminderd in omvang en aantal en activitiet. Zie hieronder de scanbeelden na aanvang van de behandeling met larotectinib:
T1-weighted brain magnetic resonance imaging (MRI) with contrast images shown pre-treatment a, d, after 2 months of treatment b, e and after 5 months of treatment c, f. The contrast enhancing suprasellar mass (red arrows, a), had resolved after 2 months of treatment b, with sustained response at 5 months (c). Tumour bed enhancement (yellow arrows) improved at 2 months (b), and near complete at 5 months c. Examples of two contrast enhancing intraventricular lesions (red circle) pre-treatment d, improved after 2 months e and with complete resolution at 5 months f. The contrasting enhancing disease in the right thalamus are also visible in e, and had completely resolved after 5 months of treatment f
Hier het abstract van de studie met referentielijst:
Clinical and Radiological Response to Larotrectinib in TRK Fusion–Driven High-Grade Glioma of a three year old girl. She comes and stays in a complete remission
Clinical Study
Brief Report: Potent clinical and radiological response to larotrectinib in TRK fusion-driven high-grade glioma
British Journal of Cancervolume 119, pages693–696 (2018)
Abstract
Genes encoding TRK are oncogenic drivers in multiple tumour types including infantile fibrosarcoma, papillary thyroid cancer and high-grade gliomas (HGG). TRK fusions have a critical role in tumourigenesis in 40% of infant HGG. Here we report the first case of a TRK fusion-driven HGG treated with larotrectinib—the first selective pan-TRK inhibitor in clinical development. This 3-year-old girl had failed multiple therapies including chemotherapy and radiotherapy. Tumour profiling confirmed an ETV6–NTRK3 fusion. Treatment with larotrectinib led to rapid clinical improvement with near total resolution of primary and metastatic lesions on MRI imaging. This is the first report of a TRK fusion glioma successfully treated with a TRK inhibitor.
Discussion
To our knowledge, this is the first reported case of treatment with, and response to, a TRK inhibitor, in a patient with a TRK fusion-driven HGG. The marked response opens a new paradigm in the management of patients with this aggressive brain tumour. While 50% of infants with HGG respond to systemic chemotherapy, progression following chemotherapy and radiotherapy remains incurable, with dismal outcomes.3,5 The response to larotrectinib following failure of multiagent chemotherapy and radiotherapy suggests that TRK inhibitor therapy should be tested in the treatment of other TRK fusion-driven gliomas.
There are several TRK inhibitors currently in development, but no clinical results have till now been published in patients with TRK-driven brain tumours. Entrectinib is a selective tyrosine kinase inhibitor of the TRK kinases, C-Ros oncogene 1 and anaplastic lymphoma kinase. It has been shown to be active in a patient with a TRK-driven non-small cell lung cancer with cerebral metastases, suggesting the potential for this class of drugs to target primary intracranial tumours.13 In the recent report on larotrectinib efficacy in paediatric and adult clinical trials, 75% of patients with a TRK-driven tumour had an objective response to therapy.14 However, no patients were reported who had brain tumours harbouring TRK fusions, and the utility of this inhibitor for these HGG patients has, until now, been unknown. This report indicates that larotrectinib penetrates the BBB and may have potent activity in TRK-driven HGG.
It is unclear whether the activity seen in this case can be translated to adults with HGGs that harbour TRK fusions. TRK fusions in adult HGG are rare,6 however, given the paucity of effective treatment options for these patients, the results here suggest that biomarker-driven trials of TRK inhibitors are warranted in adult HGG patients.
How can TRK inhibitors be incorporated into the treatment of TRK fusion-driven HGG? Most important will be the detection of fusions by immunohistochemistry, FISH or sequenced-based tumour profiling (targeted sequencing, or whole genome and transcriptome sequencing). The latter techniques provide an unbiased approach, and may identify fusions in atypical tumour types, or novel rearrangements which may not be detected with standard tests. Notably, the pan-TRK antibody used here failed to recognise the ETV6–TRK3 fusion in this case, similar to a recent analysis.15 Further assessment of larotrectinib in clinical trials of HGG patients is needed to determine whether genomic profiling should be considered early in patient work-up. More evidence is also required to integrate TRK inhibitors into standard treatment, especially as some infants have durable responses to first-line chemotherapy. TRK inhibitors could be trialled in infants with relapsed or progressive disease, and as a strategy to avoid the damaging effects of high-dose radiation therapy, or combined with chemotherapy at diagnosis. The potential for integration of this molecularly driven, targeted therapy into the treatment for patients with HGG warrants further testing in clinical trials.
Data availability
All data generated or analysed during this study are included in this published article.
References
- 1.
Jones, C. et al. Pediatric high-grade glioma: biologically and clinically in need of new thinking. NeuroOncology 19, 153–161 (2017).
- 2.
Stupp, R. et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New Engl. J. Med. 352, 987–996 (2005).
- 3.
Duffner, P. K. et al. Treatment of infants with malignant gliomas: the Pediatric Oncology Group experience. J. Neurooncol. 28, 245–256 (1996).
- 4.
Espinoza, J. C. et al. Outcome of young children with high‐grade glioma treated with irradiation‐avoiding intensive chemotherapy regimens: Final report of the Head Start II and III trials. Pediatr. Blood. Cancer 63, 1806–1813 (2016).
- 5.
Geyer, J. R. et al. Multiagent chemotherapy and deferred radiotherapy in infants with malignant brain tumors: a report from the Children’s Cancer Group. J. Clin. Oncol. 23, 7621–7631 (2005).
- 6.
Frattini, V. et al. The integrated landscape of driver genomic alterations in glioblastoma. Nat. Genet. 45, 1141 (2013).
- 7.
Prasad, M. L. et al. NTRK fusion oncogenes in pediatric papillary thyroid carcinoma in northeast United States. Cancer 122, 1097–1107 (2016).
- 8.
Doebele, R. C. et al. An oncogenic NTRK fusion in a patient with soft-tissue sarcoma with response to the tropomyosin-related kinase inhibitor LOXO-101. Cancer Discov. 5, 1049–1057 (2015).
- 9.
Wu, G. et al. The genomic landscape of diffuse intrinsic pontine glioma and pediatric non-brainstem high-grade glioma. Nat. Genet. 46, 444 (2014).
- 10.
Laetsch, T. W. et al. Larotrectinib for paediatric solid tumours harbouring NTRK gene fusions: phase 1 results from a multicentre, open-label, phase 1/2 study. Lancet Oncol. 19, 705–714 (2018).
- 11.
Hong D. S. et al. Clinical safety and activity from a phase 1 study of LOXO-101, a selective TRKA/B/C inhibitor, in solid-tumor patients with NTRK gene fusions. Eur. J. Cancer. 72, S148 (2017).
- 12.
Hechtman, J. F. et al. Pan-Trk immunohistochemistry is an efficient and reliable screen for the detection of NTRK fusions. Am. J. Surg. Pathol. 41, 1547–1551 (2017).
- 13.
Farago, A. F. et al. Durable clinical response to entrectinib in NTRK1-rearranged non-small cell lung cancer. J. Thorac. Oncol. 10, 1670–1674 (2015).
- 14.
Drilon, A. et al. Efficacy of larotrectinib in TRK fusion–positive cancers in adults and children. New Engl. J. Med. 378, 731–739 (2018).
- 15.
Gatalica, Z., Swensen, J., Kimbrough, J., Xiu J. Abstract A047: Molecular Characterization of the Malignancies with Targetable NTRK Gene Fusions (AACR, Philadelphia, PA, 2018).
Acknowledgements
We thank the Kinghorn Centre for Clinical Genomics and the Murdoch Children’s Research Institute Research Genomics laboratory for assistance with production and processing of Whole Genome, and RNA Sequencing data. We are grateful to Mr Peter Priestley for helpful discussions about whole-genome sequencing analysis. Compassionate access to larotrectinib was provided by Loxo Oncology, Inc. The brain tumour precision medicine programme was funded by the Cure Brain Cancer Foundation. Whole-Genome Sequencing was funded by the Australian Lions Childhood Cancer Research Foundation and Lions Club International Foundation (LCIF) as part of the Lions Kids Cancer Genome Project. A.K. and V.T.’s salaries were supported by the CRC for Cancer Therapeutics, E.M.’s salary was supported by The Kids Cancer Project, L.L.’s and C.M.’s salary were supported by Cancer Institute NSW, and M.J.C.’s salary was supported by NSW Department of Health Early-Mid Career Fellowship. D.K. is the Herman Clinical Fellow at the University of Melbourne. The Zero Childhood Cancer Program has also been supported by the Commonwealth Government of Australia, The NSW State Government, University of NSW, Tour de Cure, The Rich Family Foundation, the Robert Connor Dawes Foundation, and The Lenity Foundation.
Author information
Author notes
-
These authors contributed equally: Marie Wong, Chelsea Mayoh, Amit Kumar.
Affiliations
-
Kids Cancer Centre, Sydney Children’s Hospital, Randwick, NSW, Australia
- David S. Ziegler
- , Richard J. Cohn
- , Loretta M. S. Lau
- & Glenn M. Marshall
-
Children’s Cancer Institute, UNSW, Sydney, NSW, Australia
- David S. Ziegler
- , Chelsea Mayoh
- , Amit Kumar
- , Maria Tsoli
- , Emily Mould
- , Vanessa Tyrrell
- , Richard J. Cohn
- , Andrew Gifford
- , Mark J. Cowley
- , Glenn M. Marshall
- & Michelle Haber
-
Kinghorn Centre for Clinical Genomics, Garvan Institute, Sydney, NSW, Australia
- Marie Wong
- , Mark Pinese
- , Velimir Gayevskiy
- & Mark J. Cowley
-
Peter MacCallum Cancer Centre, Melbourne, VIC, Australia
- Amit Kumar
-
Murdoch Children’s Research Institute, Royal Children’s Hospital, The University of Melbourne, Melbourne, VIC, Australia
- Dong-Anh Khuong-Quang
- & Paul G. Ekert
-
Clinical Development, Loxo Oncology, Inc., South San Francisco, San Francisco, CA, USA
- Mark Reynolds
- & Michael C. Cox
-
Department of Anatomical Pathology, Prince of Wales Hospital, Randwick, NSW, Australia
- Andrew Gifford
- & Michael Rodriguez
-
St Vincent’s Clinical School, UNSW Sydney, Sydney, NSW, Australia
- Mark J. Cowley
Authors
-
Search for David S. Ziegler in:
-
Search for Marie Wong in:
-
Search for Chelsea Mayoh in:
-
Search for Amit Kumar in:
-
Search for Maria Tsoli in:
-
Search for Emily Mould in:
-
Search for Vanessa Tyrrell in:
-
Search for Dong-Anh Khuong-Quang in:
-
Search for Mark Pinese in:
-
Search for Velimir Gayevskiy in:
-
Search for Richard J. Cohn in:
-
Search for Loretta M. S. Lau in:
-
Search for Mark Reynolds in:
-
Search for Michael C. Cox in:
-
Search for Andrew Gifford in:
-
Search for Michael Rodriguez in:
-
Search for Mark J. Cowley in:
-
Search for Paul G. Ekert in:
-
Search for Glenn M. Marshall in:
-
Search for Michelle Haber in:
Contributions
M.T., E.M., V.T., D.-A.K.-Q., M.P., V.G., L.M.S.L., M.R., M.J.C., P.G.E., G.M.M. and M.H. carried out the analysis of the data; M.J.C., M.W., C.M., and A.K. performed bio-informatics analysis; R.J.C., L.M.S.L. and D.S.Z. provided clinical data; M.R. and A.G. performed histopathological analysis; M.C.C. and M.R. provided drug, M.J.C., P.G.E. and D.S.Z. wrote the paper. All authors reviewed and approved the final manuscript..
Ethics approval and consent to participate:
Tumour analysis was performed as part of the TARGET study, and was approved by the Sydney Children’s Hospital Network Human Research Ethics Committee in accordance with the Declaration of Helsinki.
Consent for publication:
Consent was provided by the parents for publication of this case.
Competing interests
M.R. is a consultant for Loxo Oncology, Inc and holds a patent 62/318,041 issued to Loxo Oncology, Inc. M.C.C. is an employee of and owns stock in Loxo Oncology, Inc and holds a patent 62/318,041 issued to Loxo Oncology, Inc. The remaining authors declare no competing interests.
Availability of data and material:
All data generated or analysed during this study are included in this published article.
Funding:
The brain tumour precision medicine program was funded by the Cure Brain Cancer Foundation. Whole-Genome Sequencing was funded by the Australian Lions Childhood Cancer Research Foundation and Lions Club International Foundation (LCIF) as part of the Lions Kids Cancer Genome Project. AK and VT’s salaries were supported by the CRC for Cancer Therapeutics, EM’s salary was supported by The Kids Cancer Project, LL’s and CM’s salary were supported by Cancer Institute NSW, and MJC’s salary was supported by NSW Department of Health Early-Mid Career Fellowship. DK is the Herman Clinical Fellow at the University of Melbourne. The Zero Childhood Cancer Program has also been supported by the Commonwealth Government of Australia, The NSW State Government, University of NSW, Tour de Cure, The Rich Family Foundation, the Robert Connor Dawes Foundation, and The Lenity Foundation.
Corresponding author
Correspondence to David S. Ziegler.
Gerelateerde artikelen
- APVACS - actief gepersonaliseerde vaccins - ontwikkelen tegen kanker wordt doel van nieuw consortium van 14 organisaties - GAPVAC, waaronder LUMC Leiden copy 1
- Hersentumoren: Biomoleculair profile onderzoek bij hersentumoren - glioblastoma multiforme maakt wezenlijk verschil in behandelingsresultaten blijkt uit twee studies
- Hersentumoren: Meisje van drie jaar komt en blijft in een complete remissie van een hersentumor glioblastoma met larotrectinib een zogeheten TRK medicijn op basis van haar ETV6–NTRK3 mutatie.
- Hersentumoren: Biomoleculair profiel van laaggradige hersentumoren - astrocytomas, oligodendrogliomas en oligoastrocytomas - ontrafelt en bepaalde mutaties geven duidelijke prognose op overlevingskansen copy 1



Plaats een reactie ...
Reageer op "Hersentumoren: Meisje van drie jaar komt en blijft in een complete remissie van een hersentumor glioblastoma met larotrectinib een zogeheten TRK medicijn op basis van haar ETV6–NTRK3 mutatie."