Helpt u ons aan 500 donateurs?
8 november 2017: Bron: J Hepatocell Carcinoma. 2015; 2: 79–89. Published online 2015 Jun 22.
Amborex, een plantenextract met immuunstimulerende kenmerken geeft als mono behandeling bij patiënten met primaire leverkanker gerelateerd aan het HPV virus uitstekende resultaten.
Bij de start van de studie, dus vóór de behandeling, werden vier patiënten geïdentificeerd met enkele tumoren Zie tabel verderop in dit artikel waar genummerd en aangeduid als 1 en 25 patiënten voor meerdere tumoren, genummerd en aangeduid als 5). Na 6 maanden van de studie toonden scans aan dat de Ambovex buitengewoon effectief was in beide groepen, wat resulteerde in grote of kleine verbeteringen of stabilisatie van de laesies / tumoren. Bij 2 patiënten verdwenen alle tumoren. En er waren nagenoeg geen ernstige bijwerkingen gerelateerd aan Ambovex.
De laesies / tumoren bij 38% van de behandelde patiënten namen af van meerdere tot enkele laesies / tumoren en gaven een belangrijke verbetering te zien, zowel in aantal als omvang, 35% van de patiënten ging van meerdere laesies / tumoren naar verminderde meerdere laesies / tumoren met een kleine verbetering in aantal en omvang, terwijl bij 27% van de patiënten het aantal en omvang van de tumoren gelijk bleef.
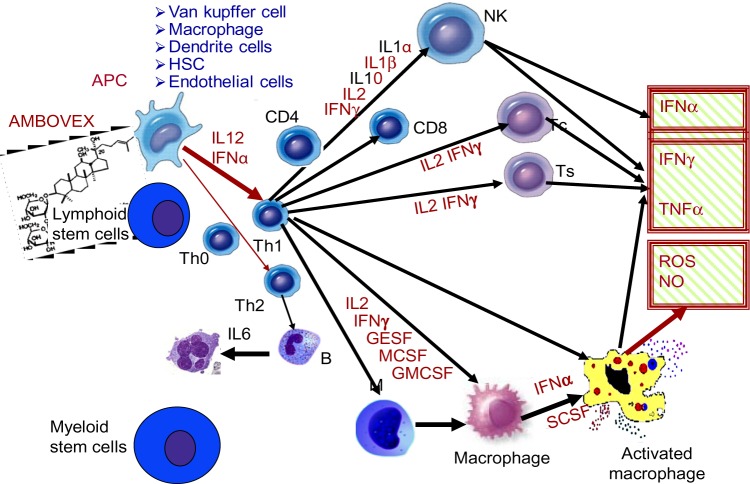
Hier het werkingsmechanisme van Ambovex op het immuunsysteem:
Zie de tabel van alle deelnemende patienten. 40 patiënten kregen de eerste vier maanden Ambovex en de laatste twee maanden gingen 33 patienten door met Ambovex en 7 patiënten kregen de laatste twee maanden beste zorg maar geen Ambovex. Zie in de tabel het effect na 1, 2, 4 en 6 maanden respectievelijk.
Table 1
US scan showing the number of focal lesions and their changes at time zero, as well as after 3 months and 6 months of Ambovex® treatment
| Patient ID | US 1 (0 months) | US 2 (3 months) | US3 (6 months) | After 3 months | After 6 months |
|---|
| 1P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 2P |
1.00 |
1.00 |
1.00 |
Stable |
Stable |
| 3P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 4P |
5.00 |
5.00 |
5.00 |
Stable |
Stable |
| 5P |
5.00 |
3.00 |
1.00 |
Minor |
Minor |
| 6P |
5.00 |
5.00 |
5.00 |
Stable |
Stable |
| 7P |
3.00 |
1.00 |
1.00 |
Major |
Major |
| 8P |
5.00 |
3.00 |
1.00 |
Minor |
Minor |
| 9P |
1.00 |
5.00 |
5.00 |
Not improved |
Not improved |
| 10P |
5.00 |
5.00 |
5.00 |
Minor |
Not improved |
| 11P |
5.00 |
5.00 |
5.00 |
Stable |
Stable |
| 12P |
5.00 |
5.00 |
3.00 |
Minor |
Minor |
| 13P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 14P |
5.00 |
5.00 |
5.00 |
Stable |
Stable |
| 15P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 16P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 17P |
5.00 |
5.00 |
3.00 |
Stable |
Minor |
| 18P |
5.00 |
3.00 |
1.00 |
Major |
Improved |
| 19P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 20P |
5.00 |
1.00 |
1.00 |
Major |
Stable |
| 21P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 22P |
5.00 |
5.00 |
5.00 |
Stable |
Stable |
| 23P |
5.00 |
3.00 |
3.00 |
Minor |
Minor |
| 24P |
5.00 |
3.00 |
3.00 |
Minor |
Minor |
| 25P |
5.00 |
5.00 |
5.00 |
Stable |
Stable |
| 26P |
5.00 |
3.00 |
3.00 |
Minor |
Minor |
| 27P |
3.00 |
3.00 |
5.00 |
Not improved |
Not improved |
| 28P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 29P |
1.00 |
1.00 |
1.00 |
Stable |
Stable |
| 30P |
5.00 |
3.00 |
1.00 |
Major |
Improved |
| 31P |
3.00 |
3.00 |
1,00 |
Major |
Improved |
| 32P |
5.00 |
5.00 |
5.00 |
Not improved |
Not improved |
| 33P |
5.00 |
3.00 |
1.00 |
Major |
Improved |
| 34P |
5.00 |
5.00 |
5.00 |
Not improved |
Not improved |
| 35P |
5.00 |
5.00 |
5.00 |
Not improved |
Not improved |
| 36P |
3.00 |
1.00 |
1.00 |
Major |
Improved |
| 37P |
5.00 |
5.00 |
5.00 |
Stabilized |
Stabilized |
| 38P |
5.00 |
3.00 |
1.00 |
Major |
Improved |
| 39P |
5.00 |
1.00 |
1.00 |
Major |
Improved |
| 40P |
5.00 |
5.00 |
5.00 |
Not improved |
Not improved |
Primaire leverkanker is vaak moeilijk te behandelen, zeker als de tumoren zo liggen dat ze inoperabel zijn en vaak snel groeien omdat de lever het meest doorbloede orgaan is van ons lichaam en tumoren zich razendsnel kunnen verspreiden in de lever. En de behandelingen die ervoor zijn zoals operatie (tot soms 75% wordt de lever weggehaald omdat die daarna weer voor 90% aangroeit), radiotherapie, chemo embolisatie, radio embolisatie en chemokuren hebben zo allemaal hun nadelen en zijn vaak ook duur en belastend voor de patiënt. In onze lijst van niet-toxische middelen en behandelingen bij leverkanker is te zien dat met name TCM - Traditionele Chinese Medicijnen / Chinese kruidenmixen en BCAA's (aminozuren) en extracten van medicinale paddenstoelen vaak een uitstekend effect hebben op levertumoren. Al of niet naast andere reguliere behandelingen.
Amborex is een zogeheten plantenderivaat en bestaat uit (in het Engels): water, ethyl alcohol, sodium benzoate, potassium phosphate dibasic, methyl paraben, propyl paraben, butyl paraben, ethylenediaminetetraacetic acid (EDTA), potassium carbonate, potassium bicarbonate, benzyl alcohol, glycerin, and flavor..
Studieresultaten:
De fase II studie betrof in totaal 40 patiënten, waarvan 33 in de behandelingsgroep en 7 in de controlegroep. De α-fetoproteïne (AFP) niveaus werden elke maand gemeten en ultrasone scans werden uitgevoerd op tijdstip nul en elke 2 maanden daarna. Computertomografie (CT) -scans werden uitgevoerd voor patiënten in de behandelingsgroep.
Ambovex bleek veilig te zijn, omdat er geen significante bijwerkingen waren, hoewel sommige patiënten vonden dat het geneesmiddel een onaangename smaak heeft. AFP-analyse toonde een significante afname van het niveau (α = 0,05, 95% betrouwbaarheidsinterval) in de behandelingsgroep in vergelijking met de controlegroep op 3 maanden (P = 0,0031) en op 6 maanden (P = 0,007).
De resultaten van de echografie toonden verbetering in de behandelde groep, zoals blijkt uit een significante afname van het aantal en omvang van de tumoren. De tumoren bij 38% van de behandelde patiënten daalden van meerdere naar enkele met belangrijke verbeteringen; 35% van de patiënten vertoonde een afname van meerdere tumoren tot meerdere tumoren met kleine verbeteringen, terwijl bij 27% van de patiënten hun aantal en omvang van de tumoren gelijk bleven.
CT-scans in de behandelde groep vertoonden een significante verbetering. Bij twee patiënten.verdwenen de tumoren volledig na 6 maanden behandeling met Ambovex
Conclusie:
Deze klinische studie toonde de effectieve en veelbelovende resultaten van Ambovex als een immunologische modulator bij de behandeling van HCC.
Hier het abstract plus referentielijst:
CT scans in the treated group showed significant improvement, as there was complete disappearance of the lesions after 6 months of treatment with Ambovex in two patients. This clinical study showed the effective and promising results of Ambovex as an immunological modulator in treating HCC.
Ambovex® as a novel immunological modulator drug for the treatment of hepatocellular carcinoma (HCC) in the liver: a Phase II clinical trial
Hosny Salama,
1 Hassan Ahmad,
2 Ismail Elchagea,
2 Abdel Rahman Zekri,
2,3 Eman Medhat,
1 Abeer Bahnassy,
3 Michael Lange,
4 Mohammed Rabbat,
4 Andrew N de la Torre,
4 and
Pravin Punamiya2
Abstract
Hepatocellular carcinoma (HCC) is a global public health problem, based on it being the fifth most common cancer and third leading cause of cancer-related mortality worldwide. The approved conventional treatment methods for HCC have shown life-threatening side effects with limited or negligible success, especially in multifocal HCC. As a consequence, new therapeutic approaches are being explored, including immunoregulatory molecules that may have the potential to treat or delay the progression of HCC. A novel pharmaceutical botanical drug – Ambovex®, an immune-modulator molecule – was tested to treat or delay the progress of HCC. We conducted a 6-month randomized clinical trial with an additional 3-month washing period (no treatment) to evaluate the safety and efficacy of low-dose Ambovex oral spray in treating patients with HCC. The clinical study involved a total of 40 patients, with 33 in the treatment group and seven in the control group. The α-fetoprotein (AFP) levels were measured every month and ultrasound scans were performed at time zero and every 2 months thereafter. Computed tomography (CT) scans were performed for patients in the treatment group. Ambovex proved to be safe, as there were no significant side effects although some patients found that the drug has unpleasant taste. AFP analysis showed a significant decrease in its level (α=0.05; 95% confidence interval) in the treatment group when compared to the control group at 3 months (P=0.0031) and at 6 months (P=0.007). The ultrasound results showed improvement in the treated group, as evidenced by a significant decrease in the lesion numbers and sizes. The lesions in 38% of treated patients decreased from multiple to single with major improvements; 35% of patients exhibited a decrease from multiple lesions to multiple lesions with minor improvements, whereas 27% had stabilized lesions. CT scans in the treated group showed significant improvement, as there was complete disappearance of the lesions after 6 months of treatment with Ambovex in two patients. This clinical study showed the effective and promising results of Ambovex as an immunological modulator in treating HCC. Further exploration of Ambovex is recommended.
References
1.
Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001;2(9):533–543. [PubMed]2.
Mazzanti R, Gramantieri L, Bolondi L. Hepatocellular carcinoma: epidemiology and clinical aspects. Mol Aspects Med. 2008;29(1–2):130–143. [PubMed]3.
Cook GC. Hepatocellular carcinoma: one of the world’s most common malignancies. Q J Med. 1985;57(223):705–708. [PubMed]4.
El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132(7):2557–2576. [PubMed]5.
Nguyen MH, Keeffe EB. General management. Best Pract Res Clin Gastroenterol. 2005;19(1):161–174. [PubMed]6.
Kanwal F, El-Serag HB. Hepatocellular cancer care: cost is important but only one factor of disease burden. J Hepatol. 2009;50(1):10–12. [PubMed]7.
Donato F, Tagger A, Gelatti U, et al. Alcohol and hepatocellular carcinoma: the effect of lifetime intake and hepatitis virus infections in men and women. Am J Epidemiol. 2002;155(4):323–331. [PubMed]8.
Di Bisceglie AM, Lyra AC, Schwartz M, et al. Liver Cancer Network Hepatitis C-related hepatocellular carcinoma in the United States: influence of ethnic status. Am J Gastroenterol. 2003;98(9):2060–2063. [PubMed]9.
Parkin DM. The global health burden of infection-associated cancers in the year 2002. Int J Cancer. 2006;118(12):3030–3044. [PubMed]10.
El-Serag HB. Hepatocellular carcinoma: recent trends in the United States. Gastroenterology. 2004;127(5 Suppl 1):S27–S34. [PubMed]11.
Gomaa AI, Khan SA, Toledano MB, Waked I, Taylor-Robinson SD. Hepatocellular carcinoma: epidemiology, risk factors and pathogenesis. World J Gastroenterol. 2008;14(27):4300–4308. [PMC free article] [PubMed]12.
Nguyen MH, Whittemore AS, Garcia RT, et al. Role of ethnicity in risk for hepatocellular carcinoma in patients with chronic hepatitis C and cirrhosis. Clin Gastroenterol Hepatol. 2004;2(9):820–824. [PubMed]13.
Chin PL, Chu DZ, Clarke KG, Odom-Maryon T, Yen Y, Wagman LD. Ethnic differences in the behavior of hepatocellular carcinoma. Cancer. 1999;85(9):1931–1936. [PubMed]14.
Hassan MM, Hwang LY, Hatten CJ, et al. Risk factors for hepatocellular carcinoma: synergism of alcohol with viral hepatitis and diabetes mellitus. Hepatology. 2002;36(5):1206–1213. [PubMed]15.
Mukaiya M, Nishi M, Miyake H, Hirata K. Chronic liver diseases for the risk of hepatocellular carcinoma: a case-control study in Japan. Etiologic association of alcohol consumption, cigarette smoking and the development of chronic liver diseases. Hepatogastroenterology. 1998;45(24):2328–2332. [PubMed]16.
Chen ZM, Liu BQ, Boreham J, Wu YP, Chen JS, Peto R. Smoking and liver cancer in China: case-control comparison of 36,000 liver cancer deaths vs. 17,000 cirrhosis deaths. Int J Cancer. 2003;107(1):106–112. [PubMed]17.
Mizoue T, Tokui N, Nishisaka K, et al. Prospective study on the relation of cigarette smoking with cancer of the liver and stomach in an endemic region. Int J Epidemiol. 2000;29(2):232–237. [PubMed]18.
Tanaka K, Hirohata T, Takeshita S, et al. Hepatitis B virus, cigarette smoking and alcohol consumption in the development of hepatocellular carcinoma: a case-control study in Fukuoka, Japan. Int J Cancer. 1992;51(4):509–514. [PubMed]19.
La Vecchia C, Negri E, Decarli A, D’Avanzo B, Franceschi S. Risk factors for hepatocellular carcinoma in northern Italy. Int J Cancer. 1988;42(6):872–876. [PubMed]20.
Evans AA, Chen G, Ross EA, Shen FM, Lin WY, London WT. Eight-year follow-up of the 90,000-person Haimen City cohort: I. Hepatocellular carcinoma mortality, risk factors, and gender differences. Cancer Epidemiol Biomarkers Prev. 2002;11(4):369–376. [PubMed]21.
Chen MF, Hwang TL, Jeng LB, Jan YY, Wang CS, Chou FF. Hepatic resection in 120 patients with hepatocellular carcinoma. Arch Surg. 1989;124(9):1025–1028. [PubMed]22.
Liaw YF, Tai DI, Chu CM, et al. Early detection of hepatocellular carcinoma in patients with chronic type B hepatitis. A prospective study. Gastroenterology. 1986;90(2):263–267. [PubMed]23.
Yoshimi F, Nagao T, Inoue S, et al. Comparison of hepatectomy and transcatheter arterial chemoembolization for the treatment of hepatocellular carcinoma: necessity for prospective randomized trial. Hepatology. 1992;16(3):702–706. [PubMed]24.
Castells A, Bruix J, Bru C, et al. Treatment of small hepatocellular carcinoma in cirrhotic patients: a cohort study comparing surgical resection and percutaneous ethanol injection. Hepatology. 1993;18(5):1121–1126. [PubMed]25.
Kotoh K, Sakai H, Sakamoto S, et al. The effect of percutaneous ethanol injection therapy on small solitary hepatocellular carcinoma is comparable to that of hepatectomy. Am J Gastroenterol. 1994;89(2):194–198. [PubMed]26.
Buscarini L, Di Stasi M, Buscarini E, et al. Clinical presentation, diagnostic work-up and therapeutic choices in two consecutive series of patients with hepatocellular carcinoma. Oncology. 1996;53(3):204–209. [PubMed]27.
Farmer DG, Rosove MH, Shaked A, Busuttil RW. Current treatment modalities for hepatocellular carcinoma. Ann Surg. 1994;219(3):236–247. [PMC free article] [PubMed]28.
Ohto M, Yoshikawa M, Saisho H, Ebara M, Sugiura N. Nonsurgical treatment of hepatocellular carcinoma in cirrhotic patients. World J Surg. 1995;19(1):42–46. [PubMed]29.
Lüth S, Huber S, Schramm C, et al. Ectopic expression of neural autoantigen in mouse liver suppresses experimental autoimmune neuroinflammation by inducing antigen-specific Tregs. J Clin Invest. 2008;118(10):3403–3410. [PMC free article] [PubMed]30. Abe M, Thomson AW. Antigen processing and presentation in the liver. In: Gerswhin ME, Vierling JM, Manns MP, editors. Liver Immunology: Principles and Practice. Totowa, NJ: Humana Press Inc; 2007. p. 486.
31.
Kamada N, Davies HS, Roser B. Reversal of transplantation immunity by liver grafting. Nature. 1981;292(5826):840–842. [PubMed]32.
Seyfert-Margolis V, Turka LA. Marking a path to transplant tolerance. J Clin Invest. 2008;118(8):2684–2686. [PMC free article] [PubMed]33.
De Minicis S, Seki E, Uchinami H, et al. Gene expression profiles during hepatic stellate cell activation in culture and in vivo. Gastroenterology. 2007;132(5):1937–1946. [PubMed]34.
Friedman SL. Liver fibrosis – from bench to bedside. J Hepatol. 2003;38(Suppl 1):S38–S53. [PubMed]35.
Limmer A, Sacher T, Alferink J, et al. Failure to induce organ-specific autoimmunity by breaking of tolerance: importance of the microenvironment. Eur J Immunol. 1998;28(8):2395–2406. [PubMed]36.
Llovet JM, Ricci S, Mazzaferro V, et al. SHARP Investigators Study Group Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359(4):378–390. [PubMed]37.
Jodo S, Kobayashi S, Nakajima Y, et al. Elevated serum levels of soluble Fas/APO-1 (CD95) in patients with hepatocellular carcinoma. Clin Exp Immunol. 1998;112(2):166–171. [PMC free article] [PubMed]38. Phase I clinical trial to evaluate the safety, tolerability and clinical pharmacology profile of Ambovex ampoules. Heidar Ghaleb IND of Ambovex. 2009;27–48:203–294.
39. Phase II clinical trial to evaluate the safety and efficacy of Ambovex Ampules given for 3 years to patients with chronic HCV infection; Amr Helmy, IASL Meeting in Cairo, Sept 2006; pp. 295–415. IND of Ambovex.
40. An open label phase II study in hepatitis C infected patients, co-infected with human immune-deficiency virus (HIV) who have failed, intolerant or having contra-indications for standard therapy. Michael Lange, MD: MPH; 2010. pp. 416–521. IND of Ambovex.
Articles from Journal of Hepatocellular Carcinoma are provided here courtesy of Dove Press
levertumoren, primaire leverkanker, HCC, plantenderivaat, Ambovex, bijwerkingen, overall overleving, immuunstimulerende eigenscahppen, immuuntherapie, T-cellen, CD4/CD8, sorafinib, leveroperatie
Gerelateerde artikelen
- Studiepublicaties van voeding, voedingstoffen, niet-toxische middelen en behandelingen uit literatuurlijst van arts-bioloog drs. Engelbert Valstar, specifiek bij leverkanker en leveruitzaaiingen
- Aerobics oefeningen gedurende 12 weken verminderen vorming van fibrose en leververvetting bij patiënten met metabole geassocieerde leververvetting (MAFLD) en verbeteren cardiovasculaire conditie
- Ambovex, een plantenderivaat met immuunstimulerende eigenschappen geeft uitstekende resultaten bij patienten met primaire leverkanker door vermindering en verdwijning van de levertumoren binnen 6 maanden
- Arabinoxylaan (MGN-3) verbetert significant 2 jaars overleving (35% vs 6,7%) en langere ziektevrije tijd (15 procent) bij lokale chemospoelingen met respectievelijk ethanol en olie bij operabele primaire leverkanker
- Arsenic trioxide intraveneus in combinatie met TACE geeft veel betere resultaten voor in longen uitgezaaide gevorderde primaire leverkanker dan TACE alleen
- BCAA, een reeks van bepaalde aminozuren gegeven aan patiënten die een leveroperatie of leverperfusie ondergingen, verkort significant de ligduur in het ziekenhuis en vermindert significant complicaties, zoals infecties
- Cannabis: UMCG Groningen gaat onderzoek doen naar effecten van wietolie - cannabis na twee genezen leverkankerpatienten copy 1
- Hoge inname van plantaardige of meervoudig onverzadigde vetten gaat gepaard met verminderd risico op primaire leverkanker - HCC
- Hyperthermie samen met TACE - Trans Arteriele Chemo Embolisatie en/of PEI (Ethanol injecties) geeft significant beter effect op overall overleving en ziektevrije tijd bij patienten met primaire leverkanker aldus een gerandomiseerde studie bij 65 patienten
- Koffie kan voor 50% risico op primaire leverkanker voorkomen, aldus twee langjarige prospectieve studies onder ca. 65.000 mensen
- Leefstijl gewoontes zoals roken, te veel en vet eten, alcohol en hepatitus B en C zijn samen voor ca. 65 procent verantwoordelijk voor primaire leverkanker.
- Leverreiniging door o.a. klisma: Het nut van leverreiniging.
- Medicinale paddestoelen: Negenjarige studie bewijst dat functionele voedingssuppletie AHCC, een mix van medicinale paddestoelen - PSK, de kans op een recidief bij leverkanker drastisch vermindert en de overlevingskans sterk vergroot
- Menatetrenone (vitamine K2) vermindert bij operabele leverkanker de kans op een recidief significant - 42,7 % na 1 jaar en 27,3% na 3 jaar ) en verbetert 3 jaars overleving met 23 %. Nieuwe meta analyse bevestigt resultaten
- Synbiotica - meerdere soorten probiotica - vermindert significant (12 tot 30 procent) kans op ernstige ontstekingen bij operatie van primaire levertumoren.
- Traditionele Chinese Kruiden - TCM voorkomen veel beter een recidief van levertumoren en geeft 45 procent betere overall overleving dan Trans Arteriele Chemo Embolisatie (TACE) copy 1
- Aanvullende - complementaire - niet toxische behandelingen en middelen bij primaire leverkanker: een overzicht




Plaats een reactie ...
Reageer op "Ambovex, een plantenderivaat met immuunstimulerende eigenschappen geeft uitstekende resultaten bij patienten met primaire leverkanker door vermindering en verdwijning van de levertumoren binnen 6 maanden"