8 december 2021: lees ook dit artikel: https://kanker-actueel.nl/ensartinib-geeft-nog-betere-resultaten-op-overleving-dan-crizotinib-bij-longkankerpatienten-met-alk-positieve-expressie-zowel-bij-systemische-als-intracraniele-ziektestadium.html
19 april 2018: lees ook update van dit artikel:
10 april 2017: lees ook dit artikel:
22 december 2014: aan onderstaand artikel kan ik deze publicatie in NEJM toevoegen:
Crizotinib was superior to standard first-line pemetrexed-plus-platinum chemotherapy in patients with previously untreated advanced ALK-positive NSCLC. (Funded by Pfizer; PROFILE 1014 ClinicalTrials.gov number, NCT01154140.)
Abstract staat onderaan artikel.
8 oktober 2014: Bron: ESMO 2014 en fase III Profile 1014 studie, Peter MacCallum Cancer Centre, Melbourne, Australia
Twee studiepresentaties over ALK remmers bij gemetastaseerde niet-kleincellige longcarcinoom (NSCLC), inclusief uitzaaiingen in de hersenen tijdens ESMO 2014 in Madrid gavenuitstekende resultaten van het gebruik van crizotinib in de eerstelijns behandeling en opvallende werkzaamheid van alectinib, een tweede generatie ALK-remmer, bij patiënten met crizotinib-resistente ziekte.
Patiënten met niet-klein-cellige longkanker NSCLC en een ALK-gen mutatie ervaarden een uitstekende en aanhoudende respons op de behandeling met ALK-remmers, met crizotinib als zijnde de first-in-class ALK-remmer. Helaas ontwikkelen nogal wat patiënten na een eerste goede reactie resistentie tegen crizotinib maar de onderzoekers proberen deze resistentie nu aan te pakken door het ontwikkelen van een volgende generatie ALK-remmers, waaronder dus alectinib, welke eerste uitstekende resultaten laat zien in een fase I/II studie uitgevoerd in het National Kyushu Cancer Center, Fukuoka, Japan.
Studieresultaten: Eerstelijns crizotinib versus pemetrexed / platina chemotherapie bij patiënten met gevorderde ALK-positieve niet-klein-cellige longkanker (NSCLC) met geen plaveiselcelcarcinoom:
De werkzaamheid van eerstelijns crizotinib in de verbetering van de progressievrije overleving (PFS) in vergelijking met standaard pemetrexed / platina chemotherapie werd vastgesteld bij patiënten met gevorderde ALK-positieve niet-klein-cellige longkanker (NSCLC) in de fase III studie PROFILE 1014 studie waarin 343 patiënten waren opgenomen. Zie in gerelateerde artikelen eerder publicatie hierover.
De resultaten werden eerder dit jaar gepresenteerd door Dr Tony Mok tijdens ASCO 2014. Dr Benjamin Salomon van het Peter MacCallum Cancer Centre, Melbourne, Australië, en hij meldde aanvullende gegevens uit deze studie tijdens ESMO 2014 (abstract 1225O).
Crizotinib is een oraal in te nemen (tablet) klein-molecuul tyrosine kinase remmer die zich op de mutaties ALK, ROS1 en BMO richt. Het is door zowel EMO als FDA goedgekeurd voor gevorderde ALK-positieve niet-klein-cellige longkanker (NSCLC). De PROFILE 1014 studie is de eerste prospectieve, gerandomiseerde fase III studie die de werkzaamheid en veiligheid van ALK-gerichte therapie vergelijkt met een standaard chemotherapie voor gevorderde ALK-positieve niet-klein-cellige longkanker (NSCLC) in de eerstelijns behandeling.
Klinische resultaten (totaal en intracraniële werkzaamheid = op uitzaaiingen in de hersenen met longkanker symptomen), met crizotinib versus standaard chemotherapie als eerstelijns behandeling werden vergeleken in deze lopende studie in meerdere ziekenhuizen bij de gehele patiëntenpopulatie en bij patiënten uit subgroepen.
Patiënten met onbehandelde gevorderde ALK-positieve niet-klein-cellige longkanker (NSCLC) met type tumor van geen plaveiselcarcinoom werden 1 op 1 gerandomiseerd ingedeeld in alleen een behandeling met crizotinib (N-172 patiënten) of een behandeling met pemetrexed (Alimta) plus cisplatine of carboplatin (N=171 patiënten). Voortzetting van of overstappen naar de groep van crizotinib na progressies van de ziekte op basis van een onafhankelijke radiologische beoordeling werd toegestaan voor patiënten uit beide groepen.
Het primaire eindpunt was progressievrije tijd (PFS) te beoordelen door een onafhankelijke radiologische scan. Secundaire eindpunten waren overall overleving (OS), intracraniële tijd (uitzaaiingen in de hersenen) tot zich progressie voordeed, tijd tot verergering van de symptomen van pijn op de borst zich voordeden,
kortademigheid of hoesten, en de veiligheid.
De studie bereikte het primaire doel:
- crizotinib was superieur aan chemotherapie bij het verlengen van de ziektevrije tijd (PFS) (mediaan 10,9 versus 7,0 maanden; hazard ratio - HR 0.45, p <0,0001).
- De verbeterde progressievrije tijd (PFS) met crizotinib werd waargenomen in de meeste subgroepen van de patiënten die werden geanalyseerd.
- De mediane progressievrije tijd (PFS) bedroeg 6,9 maanden met pemetrexed + cisplatine (HR 0,49, p <0,0001) en 7,0 maanden met pemetrexed + carboplatin (HR 0.44, p <0,0001).
- Objectieve reacties met crizotinib waren snel merkbaar en duurzaam in vergelijking met chemotherapie (74% vs 45%). Met 68% van de patiënten nog in de follow-up, was de mediane overall overleving (OS) nog niet in een van beide groepen bereikt. Er was al wel een numerieke verbetering te zien van de overall overleving (OS) in de crizotinib arm (HR 0.82, p = 0.361).
De analyse werd niet gecorrigeerd voor de mogelijk verstorende effecten van een cross-over; 70% van de patiënten in de chemotherapie groep ontvingen crizotinib na progressie van hun ziekte, dus als straks de follow-up tijd is geeindigd zal ongetwijfeld het verschil nog groter zijn als deze cross-over van patiënten
wordt gecorrigeerd.
- De intracraniële tijd (van de hersenmetastases) tot progressie voor crizotinib versus chemotherapie was HR 0,60 (een statistisch niet-significant verschil, maar slechts ongeveer 15% van de patiënten had intracraniële gebeurtenissen , bv. epilepsie aanvallen enz.).
- Bij patiënten die al vanaf de start hersenmetastasen hadden, toonde eerstelijns crizotinib een numerieke verbetering van intracraniële tijd tot progressie en vertoonde wel een statistisch significante verbetering van de intracraniële ziektecontrole na 12 weken (p = 0,0003) en 24 weken (p = 0,006).
- De tijd tot zich verergering van de symptomen voordeden was ongeveer vier keer langer in de crizotinib groep dan in de chemotherapie groep (mediaan 2,1 maanden versus 0,5 maanden; HR 0.62, p = 0,0004).
- De meest voorkomende bijwerkingen met crizotinib waren stoornissen in het zien en spijsverteringsproblemen (diarree of constipatie bv.). Bijwerkingen met pemetrexed + platina chemotherapie waren consistent met die al eerder waren gezien bij andere studies met patiënten met niet-klein-cellige longkanker (NSCLC).
Conclusie:
De auteurs concluderen dat crizotinib statistisch significante verbeteringen aantoont in progressievrije overleving en de tijd tot verergering van de symptomen versus pemetrexed / platina chemotherapie, een numerieke verbetering van intracraniële tijd tot progressie en een aanvaardbaar veiligheidsprofiel,
Crizotinib wordt voorgesteld als de standaard van eerstelijns zorg voor patiënten met behandeling van patiënten met ALK-positieve niet-klein-cellige longkanker met tumortype niet-plaveiselcelcarcinoom (NSCLC)
Het abstract van de studie zoals gepresenteerd op ESMO 2014 staat onderaan dit artikel.
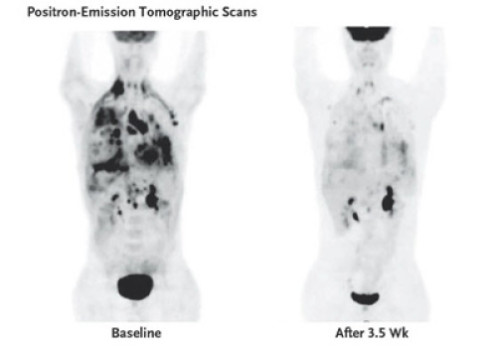
Bovenstaand beeld is een beeld van een patiënt die eerst resistent werd tegen crizotinib en daarna met een andere ALK remmer (ceritinib) werd behandeld. Hier een studie met weer een andere ALK remmer:
Studieresultaten: Antitumoractiviteit van alectinib bij patiënten resistent voor crizotinib met ALK mutatie geeft nieuwe behandelingsmogelijkheden
Alectinib toonde veelbelovende resultaten bij patiënten met uitgezaaide gevorderde longkanker met ALK mutatie die eerder al crizotinib hadden gehad.maar toch een progressie van de ziekte vertoonden. Een deel van deze patiënten had ook uitzaaiingen in de hersenen. Aldus een fase I veiligheidstudie uitgevoerd aan het National Kyushu Cancer Center, Fukuoka, Japan.
Alectinib is een zogeheten CNS-penentrant, een volgens de onderzoekers zeer selectieve ALK-remmer. Het is goedgekeurd in Japan sinds 7 april 2014 en door de FDA aangewezen als een doorbraak therapie. ALEX is een wereldwijde gerandomiseerde fase III studie, waarbij als eerstelijns behandeling alectinib versus crizotinib wordt onderzocht bij patiënten met ALK-positieve gevorderde niet-klein-cellige longkanker (NSCLC) die nog geen behandeling hebben gehad.
Deze nieuwe studie is een klinisch farmacologisch onderzoek naar de bio-equivalentie van alectinib in ALK pos. niet-klein-cellige longkanker (NSCLC) met of zonder eerdere behandeling met een andere ALK-remmer. Patiënten met ALK-pos. niet-klein-cellige longkanker (NSCLC) patiënten hadden de behandeling met crizotinib, een eerste generatie ALK-remmer, moeten stoppen als gevolg van resistentie of intolerantie. Tijdens ESMO 2014 presenteerden de onderzoekers de gegevens over de werkzaamheid bijgewerkt voor alectinib bij 28 met crizotinib voorbehandelde patiënten met gevorderde NSCLC.
Studieresultaten:
Met ingang van 11 januari 2014 was de mediane follow-up duur 141 dagen:
- 21 patiënten bleken door een voortdurende behandeling met alectinib zonder progressieve ziekte.
- Bij 24 patiënten met zichtbare tumoren werd een tumorvermindering v an meer dan 30% waargenomen bij 18 patiënten.
- Bevestigde respons was 58,3% en controle van de ziekte bedroeg 83,3%, objectief vastgesteld door de onderzoekers.
- Van de 19 patiënten die bij aanvang van de studie hersenmetastasen hadden, waren er nog steeds 13 patiënten (inclusief 4 patiënten zonder voorafgaande bestraling van de hersenen) nog steeds onder behandeling zonder progressie van de ziekte.
- Het veiligheidsprofiel bleek gunstig en geen van de patiënten stopte de behandeling om veiligheidsredenen.
- Maagstoornissen en visuele stoornissen, kenmerkend voor een crizotinib behandeling, waren mild en niet zo frequent met alectinib.
Conclusie:
De auteurs concluderen dat hun bevindingen suggereren dat alectinib een nieuwe therapeutische optie kan zijn voor crizotinib voorbehandelde ALK pos. niet-klein-cellige longkanker (NSCLC).
Van de studie: Selective ALK inhibitor alectinib with potent antitumor activity in models of crizotinib resistance, en van de studie: First-line crizotinib vs pemetrexed/platinum chemotherapy in patients with advanced ALK-positive non-squamous NSCLC volgen hieronder de abstracten zoals die zijn gepresenteerd op ESMO 2014.
Een heel interessant studierapport over welke biomarkers een rol spelen bij longkanker is deze: Biomarkers That Currently Affect Clinical Practice in Lung Cancer: EGFR, ALK, MET, ROS-1, and KRAS waarvan het volledige studierapport gratis is in te zien.
Het abstract ervan staat ook hieronder.
First-line crizotinib vs pemetrexed/platinum chemotherapy in patients with advanced ALK-positive non-squamous NSCLC
The efficacy of first-line crizotinib in improving progression-free survival (PFS) compared with standard pemetrexed/platinum chemotherapy in patients with advanced ALK-positive NSCLC was established in the phase III PROFILE 1014 study which included 343 patients. The results were presented by Dr Tony Mok earlier this year during the ASCO 2014 Annual Meeting. Dr Benjamin Solomon from the Peter MacCallum Cancer Centre, Melbourne, Australia, reported additional data from this study during the ESMO 2014 Congress (abstract 1225O).
Crizotinib is an oral small-molecule tyrosine kinase inhibitor that targets ALK, ROS1, and MET. It is approved for advanced ALK-positive NSCLC. The PROFILE 1014 is the first prospective, randomised phase III trial to compare the efficacy and safety of ALK-targeted therapy with standard chemotherapy for advanced ALK-positive NSCLC in the first-line setting.
Clinical outcomes (overall and intracranial efficacy, lung cancer symptoms) with crizotinib vs standard chemotherapy as first-line treatment were compared in this ongoing multicentre study in the whole patient population and in patient subgroups.
Patients with previously untreated advanced non-squamous ALK-positive NSCLC were randomised 1:1 to crizotinib (172 patients) or pemetrexed plus cisplatin or carboplatin (171 patients). Continuation of/crossover to crizotinib after progressions of disease per independent radiology review was allowed for patients randomised to both arms.
The primary endpoint was PFS per independent radiology review. Secondary endpoints included overall survival (OS), intracranial time to progression, time to deterioration in symptoms of chest pain, dyspnoea, or cough, and safety.
The study met its primary objective: crizotinib was superior to chemotherapy in prolonging PFS (median 10.9 vs 7.0 months; hazard ratio - HR 0.45, p < 0.0001). The PFS benefit with crizotinib was observed in most patient subgroups analysed. Median PFS was 6.9 months with pemetrexed/cisplatin (HR 0.49, p < 0.0001) and 7.0 months with pemetrexed/carboplatin (HR 0.44, p < 0.0001).
Objective responses with crizotinib were rapid and durable when compared with chemotherapy (74% vs 45%). With 68% of patients still in follow-up, median OS was not reached in either arm. There was a numerical improvement in OS in the crizotinib arm (HR 0.82, p = 0.361).
Analysis was not adjusted for the potentially confounding effects of crossover; 70% of patients in the chemotherapy arm received crizotinib after progression.
The intracranial time to progression HR for crizotinib vs chemotherapy was 0.60 (non-significant difference; only around 15% of patients had intracranial events). In patients with baseline brain metastases, first-line crizotinib showed a numerical improvement in intracranial time to progression and demonstrated a statistically significant improvement in intracranial disease control rate at 12 (p = 0.0003) and 24 weeks (p = 0.006).
The time to deterioration in symptoms was around four times longer in the crizotinib arm than in the chemotherapy arm (median 2.1 months vs 0.5 months; HR 0.62; p = 0.0004).
The most common adverse events of any cause with crizotinib were vision disorder and gastrointestinal symptoms. Adverse events with pemterexed/platinum chemotherapy were consistent with those previously reported in unselected NSCLC.
The authors concluded that crizotinib showed significant improvements in PFS and the time to deterioration in symptoms vs pemetrexed/platinum chemotherapy, a numerical improvement in intracranial time to progression, and an acceptable safety profile, establishing crizotinib as the standard of care for patients with treatment-naive advanced ALK-positive non-squamous NSCLC.
The study was sponsored by Pfizer
Antitumour activity of alectinib in crizotinib pre-treated ALK-rearranged NSCLC
Alectinib showed promising response, including patients with brain metastases, and good tolerability in crizotinib pre-treated NSCLC patients, according to the updated efficacy and safety data from the JP28927 study. The results were presented by Dr Takashi Seto from the National Kyushu Cancer Center, Fukuoka, Japan during the ESMO 2014 Congress (abstract 1224O).
Alectinib is a CNS-penentrant, highly selective ALK inhibitor. It is approved in Japan since 7 April 2014 and designated by FDA as a breakthrough therapy. ALEX is a global randomised, phase III, first-line study of alectinib vs crizotinib that currently recruits treatment-naive patients with ALK-positive advanced NSCLC.
The JP28927 is a clinical pharmacological study to evaluate the bioequivalence of alectinib in ALK-rearranged NSCLC patients with or without previous treatment with ALK inhibitor. The results for bioequivalence, food effect, efficacy and safety were reported earlier this year at ASCO 2014 Annual Meeting.
ALK-rearranged NSCLC patients had to discontinue treatment from crizotinib, a first generation ALK inhibitor, because of drug resistance or intolerance. During the ESMO 2014, the investigators presented updated efficacy and safety data for alectinib in 28 crizotinib pre-treated NSCLC patients included in this study.
As of 11 January, 2014, median follow-up duration was 141 days and 21 patients continued treatment with alectinib without progressive disease. Among 24 patients with target lesions, tumour shrinkage of more than 30% was observed in 18 patients. Confirmed response rate was 58.3% and disease control rate was 83.3 % as assessed by study investigators.
From 19 patients who had brain metastases at baseline, 13 (including 4 patients without prior brain irradiation) were still on study treatment without disease progression.
The safety profile was favourable and continued the same trend previously reported. No patients discontinued study treatment for a safety reason. Gastrointestinal and visual disorders, characteristic for crizotinib treatment, were mild and not so frequent with alectinib.
The authors concluded that their findings suggest that alectinib is a novel therapeutic option for crizotinib pre-treated ALK-rearranged NSCLC.
The study was sponsored by Chugai Pharmaceutical Co., Ltd.
Defining and refining the ALK treatment paradigm in NSCLC
Dr Alice Shaw, who discussed the results of both studies, said that for patients with advanced ALK-positive NSCLC crizotinib represents a standard first-line therapy. However, it has modest activity in the CNS. Next generation ALK inhibitors, like alectinib and ceritinib, are active in patients who relapse on crizotinib, and represent a new standard of care.
Further studies are needed to determine the optimal sequencing of ALK inhibitors. The open questions, according to Dr Shaw, are:
- should a next generation ALK inhibitor be used as first-line therapy;
- which ALK inhibitor should be used in the second-line setting in term of CNS efficacy, tolerability, and resistance mechanism;
- is there a role for a third-line ALK inhibitor in term of CNS disease and resistance mechanism.
Crizotinib was superior to standard first-line pemetrexed-plus-platinum chemotherapy in patients with previously untreated advanced ALK-positive NSCLC
Original Article
First-Line Crizotinib versus Chemotherapy in ALK-Positive Lung Cancer
N Engl J Med 2014; 371:2167-2177 December 4, 2014 DOI: 10.1056/NEJMoa1408440
Background
The efficacy of the ALK inhibitor crizotinib as compared with standard chemotherapy as first-line treatment for advanced ALK-positive non–small-cell lung cancer (NSCLC) is unknown.
Methods
We conducted an open-label, phase 3 trial comparing crizotinib with chemotherapy in 343 patients with advanced ALK-positive nonsquamous NSCLC who had received no previous systemic treatment for advanced disease. Patients were randomly assigned to receive oral crizotinib at a dose of 250 mg twice daily or to receive intravenous chemotherapy (pemetrexed, 500 mg per square meter of body-surface area, plus either cisplatin, 75 mg per square meter, or carboplatin, target area under the curve of 5 to 6 mg per milliliter per minute) every 3 weeks for up to six cycles. Crossover to crizotinib treatment after disease progression was permitted for patients receiving chemotherapy. The primary end point was progression-free survival as assessed by independent radiologic review.
Results
Progression-free survival was significantly longer with crizotinib than with chemotherapy (median, 10.9 months vs. 7.0 months; hazard ratio for progression or death with crizotinib, 0.45; 95% confidence interval , 0.35 to 0.60; P<0.001). Objective response rates were 74% and 45%, respectively (P<0.001). Median overall survival was not reached in either group (hazard ratio for death with crizotinib, 0.82; 95% CI, 0.54 to 1.26; P=0.36); the probability of 1-year survival was 84% with crizotinib and 79% with chemotherapy. The most common adverse events with crizotinib were vision disorders, diarrhea, nausea, and edema, and the most common events with chemotherapy were nausea, fatigue, vomiting, and decreased appetite. As compared with chemotherapy, crizotinib was associated with greater reduction in lung cancer symptoms and greater improvement in quality of life.
Conclusions
Crizotinib was superior to standard first-line pemetrexed-plus-platinum chemotherapy in patients with previously untreated advanced ALK-positive NSCLC. (Funded by Pfizer; PROFILE 1014 ClinicalTrials.gov number, NCT01154140.)
Gerelateerde artikelen
- Crizotinib en alectinib, twee ALK-remmers, blijken uitstekende resultaten te geven voor niet-klein-cellige longkanker met ALK pos. mutaties, zelfs voor patienten met hersenuitzaaiingen
- Crizotinib is superieur aan pemetrexed - Alimta of chemo - docetaxel bij niet-klein-cellige longkanker met ALK positieve genmutatie



Plaats een reactie ...
2 Reacties op "Crizotinib en alectinib, twee ALK-remmers, blijken uitstekende resultaten te geven voor niet-klein-cellige longkanker met ALK pos. mutaties, zelfs voor patienten met hersenuitzaaiingen"