Helpt u ons om kanker-actueel online te houden door donateur te worden?
30 april 2019: Komende week zal deze fasae III studie gepresenteerd worden (klik op de link voor het volledige studierapport):
Bij onderstaande patienten werd over drie verschillende groepen een analyse gemaakt

Met als belangrijkste conclusie:
- PROSTVAC was veilig en werd goed getolereerd maar had geen klinisch effect bij patiënten met uitgezaaide hormoonresistente prostaatkanker.
Maar wat wil je ook als de analyse al na 6 maanden gedaan wordt en dan ook nog met zwaar voorbehandelde prostaatkankerpatiënten. Het zou interessant zijn om prostvac-VF uit te proberen na de eerste diagnose bij patienten maar omdat andere middelen heel effectief zijn en de mediane overall overleving voor veel patienten 10 jaar of langer is zal daar wel geen interesse in zijn.
Hoewel deze studie wel immuuntherapie inzet bij prostaatkankerpatiënten in een wait-and-see programma. Zie ook in gerelateerde artikelen dit artikel:
5 juni 2018: Bron ASCO 2018
Vorig jaar werd ineens onverwacht de fase III studie (PROSPECFT studie) stopgezet. Omdat er bij 80 procent van de studietijd geen significante verschillen zouden zijn in overall overleving. Het opmerkelijke daaraan was dat Bristol Meyers (producent van de dure anti-PD medicijnen) het farmaceutische bedrijf heeft overgenomen dat in eerste instantie de Prostvac-VF had onderzocht.
Nu tijdens ASCO 2018 is de definitieve analyse vrij gegeven waarin dus de 44 procent betere overall overleving uit de fase II studie bij lange na niet werd gehaald en de verschillen tussen de drie groepen min of meer gelijk lagen wat betreft overall overleving. Dit is toch wel een heel opmerkelijk verschil. Mediaan leefden de patienten uit de vaccingroep 1 jaar langer dan op historische gronden verwacht mocht worden, maar dat schrijven de onderzoekers toe aan de verbeterde medicijnen en behandelingen na 2011 toen de studie begon.
Het volledige studierapport is nergens in te zien. Maar ik hoop dit wel te verkrijgen via een van mijn contacten.
Het persbericht met de resultaten van ASCO staat onderaan dit artikel.
2 januari 2016: Afgelopen najaar is er een zogeheten revisited analyse verschenen van de fase II studie met Prostvac-VF. Met nog indrukwekkender resultaten als uit de eerste analyse. 44 procent minder kans op overlijden aan prostaatkanker voor de Prostvac-VF patiënten dan voor de patienten uit de controlegroep.
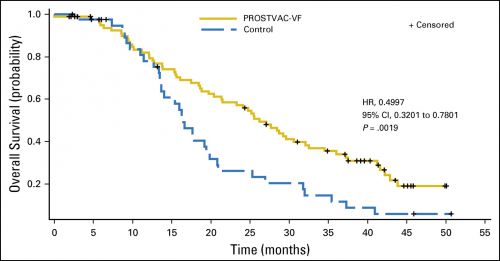
Hier de grafiek van de overall overleving die maar door blijft lopen en eigenlijk steeds beter wordt:
Bron: Journal of Clinical Oncology
De gereviseerde overall overleving (OS) voor de stratified intention-to-treat population (Fig 1) was statistisch significant langer voor de PROSTVAC-VF groep dan voor de controle groep (leeg infuus; 26.2 v 16.3 maanden, respectievelijk; stratified hazard ratio, 0.4997; 95% CI, 0.3201 to 0.7801; stratified log-rank P = .0019).
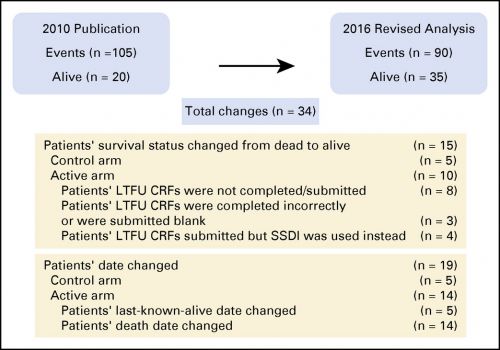
Hier een grafiek van de verschillen die zijn gemaakt in de uiteindelijke analyse tussen de twee momenten van analyse hoewel de conclusie enz. hetzelfde blijft. Zie verder onder deze grafiek voor meer informatie over deze studie
Het studierapport: Overall Survival Analysis of a Phase II Randomized Controlled Trial of a Poxviral-Based PSA-Targeted Immunotherapy in Metastatic Castration-Resistant Prostate Cancer is in Clinical Onxcology gepubliceerd.
Het studieprotocol van een nieuwe fase III studie staat hier:
Maar in tegenstelling tot een andere studie kunnen nu patienten meedoen met al een vroeg stadium van hun ziekte, zie studieprotocol voor de criteria, helaas nemen ze geen patienten meer aan (This study is ongoing, but not recruiting participants.), maar hopelijk worden nieuwe studies geopend:
Hier staan alle 222 ziekenhuizen die meedoen aan deze studie:
https://clinicaltrials.gov/ct2/show/study/NCT01322490?show_locs=Y#locn
Op de website van Bavarian-Nordic, de producent van het Prostvac-VF staat ook een korte beschrijving van hoe de studie is opgezet:
http://www.bavarian-nordic.com/pipeline/prostvac/prospect-phase-3-clinical-study.aspx
Deze studie: Randomized phase II trial of docetaxel with or without PSA-TRICOM vaccine in patients with castrate-resistant metastatic prostate cancer: A trial of the ECOG-ACRIN cancer research group (E1809) waarin Prostavac-VF naast docetaxel werd onderzocht is vroegtijdig stopgezet omdat ze niet voldoende patienten kondern werven. Het studierapport is wel gratis in te zien mewt een referentielijst.
6 april 2016: Zie ook dit artikel:
https://kanker-actueel.nl/NL/immuuntherapie-met-dendritische-celtherapie-voor-patienten-met-uitgezaaide-hormoon-resistente-prostaatkanker-nog-open-voor-patienten.html
25 februari 2014: Bron: J Clin Oncol. 2010 Mar 1;28(7):1099-105. doi: 10.1200/JCO.2009.25.0597. Epub 2010 Jan 25
Prostac-vac-V/F (PSA-TRICOM), een immuuntherapie met een zogeheten gemodificeerd kippenpokkenvirus, geeft uitstekende resultaten op overall overleving en progressievrije tijd bij hormoonresistente prostaatkanker. Na 3 jaar bleek de overall overleving al 30% beter in vergelijking met de controlegroep en de progressievrije tijd bleek na drie jaar al 8,5 maand meer te zijn dan in de controlegroep. En die resultaten kunnen alleen maar beter worden omdat veel patiënten die goed reageerden op deze vorm van immuuntherapie in principe genezen lijken te zijn.
Interessant is dat vooraf bij de mannen ook bepaalde biomarkers en zelfs de bloedgroep (A) kunnen voorspellen of deze aanpak aan zal slaan met dit gemodificeerd kippenpokkenvirus. Zie studie beschrijving daarvan onderaan artikel.
In 182 landen, waaronder België zijn inmiddels fase III studies hiermee opgezet en kunnen mensen zich inschrijven en Nederland volgt binnenkort vertelde een betrokken oncoloog mij laatst. Het studieprotocol van de fase III studie staat hier: A Randomized, Double-blind, Phase 3 Efficacy Trial of PROSTVAC-V/F +/- GM-CSF in Men With Asymptomatic or Minimally Symptomatic Metastatic Castrate-Resistant Prostate Cancer (Prospect)
Studieresultaten:
Patiënten en methoden:
In totaal 125 patiënten werden willekeurig ingedeeld in twee groepen verdeeld over verschillende ziekenhuizen voor een behandeling met een vaccinatie met het gemodificeerde pokkenvirus - Prostac-v/f. De deelnemende patiënten hadden minimaal symptomatische uitgezaaide hormoonresistente prostaatkanker ( mCRPC ).
PROSTVAC - VF omvat twee recombinante virale vectoren, elk gecodeerd voor PSA gerelateerde transgenen en drie immuun stimulerende moleculen ( B7.1 , ICAM - 1 en LFA - 3 ) Een zogeheten geloogde vaccinatie (Vector) werd gebruikt voor de eerste injectie (Vector means any agent that acts as a carrier or transporter, as a virus or plasmid that conveys a genetically engineered DNA segment into a host cell), gevolgd door zes injecties met het gemodificeerde kippenpokkenvirus om de basis vaccinatie te stimuleren. Patiënten werden in een 2 tot 1 verhouding blind en gerandomiseerd aan de groepen toegewezen. 82 patiënten ontvingen PROSTVAC-VF plus een granulocyte-macrophage colony-stimulating factor. 40 patiënten kregen lege vectors plus een zoutoplossing. Kenmerken van de patiënten waren vergelijkbaar in beide groepen.
Resultaten:
Het primaire doel was progressievrije tijd (PFS), die vergelijkbaar was in de twee groepen ( P = 0,6 ). Echter, 3 jaar na de studie, bleken de PROSTVAC - VF patiënten een betere overall overleving (OS) te hebben. 25 mannen ( 30 % ) van de 82 mannen waren nog in leven tegenover 7 mannen ( 17 % ) uit de groep van 40 mannen uit de controlegroep. De mediane progressievrije tijd steeg op 3 jaars meting met 8,5 maanden ( 25,1 tegen 16,6 maanden) , een geschatte hazard ratio van 00:56 ( 95% CI , 0,85 tot 0:37 ) en gestratificeerde log -rank van p = 0,0061.
Conclusie:
PROSTVAC -VF immuuntherapie werd goed verdragen en geassocieerd met een vermindering van 44% op de kans te overlijden (OS) en gaf 8,5 maand langere progressievrij tijd bij mannen met uitgezaaide hormoonresistente prostaatkanker (mCRPC) .
Deze gegevens geven voorlopig het bewijs van een significant klinisch voordeel , maar moeten in een grotere fase III studie worden bevestigd. Aldus de onderzoekers
Maar dat gebeurt dus nu ook, zie studieprotocol van fase III studie: A Randomized, Double-blind, Phase 3 Efficacy Trial of PROSTVAC-V/F +/- GM-CSF in Men With Asymptomatic or Minimally Symptomatic Metastatic Castrate-Resistant Prostate Cancer (Prospect)
Het studierapport: Overall Survival Analysis of a Phase II Randomized Controlled Trial of a Poxviral-Based PSA-Targeted Immunotherapy in Metastatic Castration-Resistant Prostate Cancer is gratis in te zien. Het abstract staat hieronder.
Hieronder het abstract van de studie Serum antibodies to blood group A predict survival on PROSTVAC-VF en het volledige studierapport daarvan is tegen betaling in te zien.
Interessant is ook dit studierapport over welke biomarkers uit het bloed een rol kunnen spelen bij immuuntherapie met pokkenvirussen: Poxviral vectors for cancer immunotherapy en het volledig studierapport daarvan is gratis in te zien
Hier de abstracten van genoemde studies:
PROSTVAC-VF immunotherapy was well tolerated and associated with a 44% reduction in the death rate and an 8.5-month improvement in median OS in men with mCRPC
Overall survival analysis of a phase II randomized controlled trial of a Poxviral-based PSA-targeted immunotherapy in metastatic castration-resistant prostate cancer.
Abstract
PURPOSE:
Therapeutic prostate-specific antigen (PSA) -targeted poxviral vaccines for prostate cancer have been well tolerated. PROSTVAC-VF treatment was evaluated for safety and for prolongation of progression-free survival (PFS) and overall survival (OS) in a randomized, controlled, and blinded phase II study.
PATIENTS AND METHODS:
In total, 125 patients were randomly assigned in a multicenter trial of vaccination series. Eligible patients had minimally symptomatic castration-resistant metastatic prostate cancer (mCRPC). PROSTVAC-VF comprises two recombinant viral vectors, each encoding transgenes for PSA, and three immune costimulatory molecules (B7.1, ICAM-1, and LFA-3). Vaccinia-based vector was used for priming followed by six planned fowlpox-based vector boosts. Patients were allocated (2:1) to PROSTVAC-VF plus granulocyte-macrophage colony-stimulating factor or to control empty vectors plus saline injections.
RESULTS:
Eighty-two patients received PROSTVAC-VF and 40 received control vectors. Patient characteristics were similar in both groups. The primary end point was PFS, which was similar in the two groups (P = .6). However, at 3 years post study, PROSTVAC-VF patients had a better OS with 25 (30%) of 82 alive versus 7 (17%) of 40 controls, longer median survival by 8.5 months (25.1 v 16.6 months for controls), an estimated hazard ratio of 0.56 (95% CI, 0.37 to 0.85), and stratified log-rank P = .0061.
CONCLUSION:
PROSTVAC-VF immunotherapy was well tolerated and associated with a 44% reduction in the death rate and an 8.5-month improvement in median OS in men with mCRPC. These provocative data provide preliminary evidence of clinically meaningful benefit but need to be confirmed in a larger phase III study.
Comment in
- Poxviral-based prostate-specific antigen vaccine in prostate cancer. [J Clin Oncol. 2010]
- Developing immunotherapy as legitimate therapy for patients with prostate cancer. [J Clin Oncol. 2010]
- Words of wisdom. Re: Overall survival analysis of a phase II randomized controlled trial of a poxviral-based PSA-targeted immunotherapy in metastatic castration-resistant prostate cancer. Kantoff PW, Schuetz TJ, Blumenstein BA, et al. [Eur Urol. 2010]
- Words of wisdom. Re: overall survival analysis of a phase II randomized controlled trial of a Poxviral-based PSA-targeted immunotherapy in metastatic castration-resistant prostate cancer. [Eur Urol. 2010]
- PMID:
- 20100959
- [PubMed - indexed for MEDLINE]
- PMCID:
- PMC2834462
In addition to reporting a new potentially predictive biomarker for PROSTVAC-VF, this study highlights the use of glycan microarray technology for improving our understanding of vaccine immunology
Serum antibodies to blood group A predict survival on PROSTVAC-VF.
Abstract
PURPOSE:
There is evidence that therapeutic cancer vaccines can lengthen survival for some patients with cancer, but responses vary widely from one person to another. Methods to predict clinical outcomes will advance the field and provide new insights into critical determinants of in vivo efficacy.
EXPERIMENTAL DESIGN:
This retrospective study included 141 subjects from phase II trials of PROSTVAC-VF, a poxvirus-based cancer vaccine currently in phase III clinical trials for advanced prostate cancer. A glycan microarray was used to profile prevaccination antiglycan antibody populations in sera as potential biomarkers for PROSTVAC-VF. The screen for predictive biomarkers identified antiglycan antibodies that consistently stratified subjects into groups with different Kaplan-Meier survival estimates. Because of the potential for overfitting, a permutation test was used to estimate the false discovery rate.
RESULTS:
Prevaccination antibody levels to blood group A trisaccharide (BG-Atri) were found to have a statistically significant correlation with survival. Long-term survival was approximately doubled in subjects with abundant anti-BG-Atri immunoglobulin M (IgM) relative to subjects with little or no preexisting IgM for BG-Atri. This survival correlation was specific to vaccine treatment, as no correlation was observed in control patients immunized with wild-type poxviruses lacking the key tumor antigen, prostate-specific antigen (PSA). Moreover, anti-BG-Atri IgM levels were not correlated with general measures of disease severity, such as PSA levels, Gleason score, or Halabi predicted survival.
CONCLUSION:
In addition to reporting a new potentially predictive biomarker for PROSTVAC-VF, this study highlights the use of glycan microarray technology for improving our understanding of vaccine immunology. Clin Cancer Res; 19(5); 1290-9. ©2012 AACR.
©2012 AACR.
- PMID:
- 23362327
- [PubMed - indexed for MEDLINE]
- PMCID:
- PMC3594414
- [Available on 2014/3/1]
The challenges of translating the science of immunotherapy to clinical practice include clinical trial design that includes appropriate patient selection, appropriate endpoints, and identification of meaningful surrogate biomarkers
Poxviral vectors for cancer immunotherapy
Abstract
Introduction
Poxviral vaccines have been given to over 1 billion people in the successful global eradication of smallpox. Since then, recombinant poxviruses have been investigated extensively as a novel immunotherapy for cancer, undergoing several iterations to optimize their immunogenicity and efficacy. The current platform expressing multiple costimulatory molecules plus a tumor-associated antigen such as PSA, i.e., PSA-TRICOM (PROSTVAC-V/F), is promising and is currently in a phase III randomized, placebo-controlled clinical trial in metastatic castration-resistant prostate cancer.
Areas covered
This review discusses the clinical development of poxviral-based cancer vaccines, with a particular focus on the rationale for combining vaccines with other treatment modalities, including radiotherapy, chemotherapy, hormonal therapy, other immune-based therapies, and molecularly targeted therapy. We also discuss the importance of appropriate patient selection in clinical trial design.
Expert Opinion
Preclinical and early clinical studies with poxviral vector vaccines have shown promising results with this novel immunologic approach both as vaccine alone and combined with other therapies. The challenges of translating the science of immunotherapy to clinical practice include clinical trial design that includes appropriate patient selection, appropriate endpoints, and identification of meaningful surrogate biomarkers.
ASCO 2018: Vaccine (PSA-TRICOM) Fails to Show Benefit for Prostate Cancer
June 4, 2018—Chicago, Illinois—A phase III trial of rilimogene galvacirepvec-rilimogene glafolivec (Prostvac-VF®, PSA-TRICOM), a poxvirus-based cancer vaccine targeting the prostate specific antigen (PSA) in men with prostate cancer, failed to confirm the benefits shown in a phase II trial, said investigators at the 2018 American Society of Clinical Oncology (ASCO) Annual Meeting,from June 1 to 5. PSA-TRICOM consists of 2 recombinant viral vectors, each encoding transgenes for PSA, and 3 immune costimulatory molecules (B7.1, ICAM-1, and LFA-3, also known as TRICOM). PSA-TRICOM vaccines infect antigen-presenting cells (APCs) which generate immune modulating proteins, which are expressed on the surface of the APCs. The interaction of these APCs with T cells initiates a targeted immune response and T-cell–mediated tumor cell destruction.
In the randomized, phase II RandPh2 trial, men with asymptomatic or minimally symptomatic metastatic, castration-resistant prostate cancer were allocated (2:1) to PSA-TRICOM plus granulocyte-macrophage colony-stimulating factor (GM-CSF) (n = 82) or to control empty vectors plus saline injections (n = 40). Progression-free survival (PFS), the primary endpoint, was not different in the two groups (P = .6). However, 3 years after the study, patients who had been given PSA-TRICOM had a better overall survival (OS) with 25 (30%) of 82 patients alive versus 7 (17%) of 40 controls, resulting in a longer median survival by 8.5 months (25.1 vs. 16.6 months for controls), estimated hazard ratio of 0.56 (95% confidence interval, 0.37–0.85), and stratified log-rank P = .0061. In other words, PSA-TRICOM led to a 44% reduction in the death rate and an 8.5-month improvement in median OS in men with minimally symptomatic castration-resistant metastatic prostate cancer.
These promising results led to the phase III confirmatory PROSPECT trial reported at ASCO. In this 3-arm trial, 1297 men were randomized to (1) PSA-TRICOM + placebo, (2) PSA-TRICOM + GM-CSF, or (3) placebo + placebo. Subjects were stratified per PSA < or ≥ 50 ng/mL and lactate dehydrogenase < or ≥ 200 U/L. The primary endpoint was OS; secondary endpoints included being alive without an event at 6 months and safety.
The demographics of the study patients were similar. Sites of metastases included bone 74.7%, lymph nodes 15.7%, and visceral sites 8.4%. After 80% of expected deaths was reached, the data monitoring committee recommended closure of the study on grounds of futility.
The Kaplan-Meier survival curves showed a substantial overlap between the 3 arms, and there were no statistical significant differences between them. The median OS was 34.8, 33.9, and 34.7 months for arms 1, 2, and 3, respectively. The hazard ratios on 2 prespecified comparisons were 1 versus 3: 1.02 (P = .40) and 2 versus 3: 1.03 (P = .66).
Also, no benefit was seen in the secondary endpoint of being alive without an event at 6 months. A total of 91% of patients experienced adverse events (AEs) of any grade, and 65% experienced injection site reactions; however, only 5.8% discontinued treatment due to AEs.
In summary, the PROSPECT trial failed to confirm a survival benefit observed in the prior, phase II RandPh2 trial. However, the OS observed in all arms was approximately 1 year longer than anticipated based on historical controls. This was thought to be due to improved standard of care because study enrollment began in 2011.
Gerelateerde artikelen
- Ipilimumab plus nivolumab geeft bij moleculair geselecteerde castratieresistente prostaatkankerpatienten met gevorderde ziekte zeer goede respons en lange ziekteprogressievrije tijd bij patienten met mismatch repair deficiency
- AMG 509 - Xaluritamig, een bispecifiek antilichaam dat zich richt op het antigen STEP1 geeft bij zwaar voorbehandelde prostaatkankerpatienten hoopvolle resultaten
- anti-HER2 geactiveerde T-cellen (BAT's) naast pembrolizumab geeft bij patiënten met vergevorderde uitgezaaide hormoonresistente prostaatkanker alsnog goede resultaten op progressievrije ziekte en overall overleving
- Immuuntherapie met P-PSMA-101 = CAR-T-celtherapie gericht op PMSA geeft veelbelovende resultaten met zelfs een complete remissie bij 10 zwaar voorbehandelde patienten met vergevorderde uitgezaaide hormoonresistente prostaatkanker.
- Pembrolizumab plus olaparib geeft betere respons en ziekteprogressievrije overleving bij patiënten met eerder behandelde uitgezaaide prostaatkanker in vergelijking met abirateron of enzalutamide maar niet statistisch significant
- Valacyclovir, een herpes medicijn plus een gemoduleerd virus naast radiotherapie en met of zonder hormoontherapie bij prostaatkankerpatienten geeft betere overleving (plus 20 procent) in vergelijking met historische statististische cijfers
- Immuuntherapie met pembrolizumab plus docetaxel en prednison geeft alsnog goede resultaten bij met abiraterone of enzalutamide voorbehandelde patiënten met uitgezaaide prostaatkanker
- Prostac-VF: immuuntherapie met gemodificeerd pokkenvirus geeft uitstekende resultaten op overleving en progressievrije tijd bij uitgezaaide hormoon resistente prostaatkanker
- ProscaVax, een vaccin bestaande uit een aan PSA gerelateerd eiwit samen met IL-2 en GM-CSF geeft 70 procent tumorvermindering bij recidief van prostaatkanker met oplopende PSA
- Weinig patienten met prostaatkanker hebben mutaties als microsatellite instability–high (MSI-H) of mismatch repair–deficinet (dMMR)maar als ze het hebben kan immuuntherapie met anti-PD medicijnen voor langdurige levensverlenging zorgen
- Immuuntherapie met pembrolizumab bij zwaar voorbehandelde prostaatkankerpatienten met uitgezaaide hormoonresistente ziekte geeft toch nog goede resultaten blijkt uit de Keynote-28 studie
- Immuuntherapie voor uitgezaaide hormoon resistente prostaatkanker. Een reviewstudie van recente ontwikkelingen
- Provenge een immuuntherapie met dendritische cellen bij prostaatkanker: een aantal artikelen bij elkaar gezet
- immuuntherapie met pembrolizumab - een anti-PD medicijn geeft onverwacht zeer goede resultaten na falen van enzalutamide bij patienten met vergevorderde uitgezaaide prostaatkanker.
- Immuuntherapie met dendritische celtherapie voor patiënten met uitgezaaide hormoon resistente prostaatkanker nog open voor patienten
- Immuuntherapie: Drie nieuwe studies bewijzen waarde van immuuntherapie bij gevorderde uitgezaaide hormoonresistente prostaatkanker, er wordt zelfs over genezende aanpak gesproken
- Erasmus Medisch Centrum start fase I studie met oncolitisch virus bij niet uitgezaaide lokale prostaatkanker
- Dendritische celtherapie bij prostaatkanker: overzichtstudie is positief over deze aanpak, maar vraagt meer onderzoek naar combinaties van dendritische cellen met tumor gerelateerde antigenen - eiwitten en in combinatie met andere behandelingswijzen.
- Dendritische celtherapie bij prostaatkanker: Amerikaanse studie heeft studie gestart in 2008 gepromoveerd tot fase II studie
- Combinatie van hormoontherapie met een gen - en immuuntherapie in de vorm van een vaccin - dendritische celtherapie voor mannen met uitgezaaide prostaatkanker gestart in VUMC en voortgezet in Amerika
- Vaccin tegen prostaatkanker blijkt effectief tonen dierstudies aan.
- Squalamine is een natuurlijke angiogeneseremmer ter voorkoming van een recidief van prostaatkanker en andere vormen van kanker. Een overzichtstudie.
- Meta analyse (overzicht van gerandomiseerde studies) toont aan dat immuuntherapie voor hoopvolle resultaten zorgt waarbij dendritische celtherapie eruit springt als meest zinvolle aanpak.
- Injecties met Gc-MAF een vitamine D verbindend eiwit werkt uiterst effectief (100% genezing bij totaal 16 prostaatkankerpatienten) als vernietiging en bescherming tegen terugkeer van prostaatkanker.
- Immuuntherapeutische aanpak, waaronder dendritische celtherapie bij prostaatkanker: een overzicht van belangrijke studies en recente ontwikkelingen.











Plaats een reactie ...
Reageer op "Prostac-VF: immuuntherapie met gemodificeerd pokkenvirus geeft uitstekende resultaten op overleving en progressievrije tijd bij uitgezaaide hormoon resistente prostaatkanker"