Helpt u ons aan 500 donateurs?
19 mei 2018: lees ook dit artikel:
https://kanker-actueel.nl/ivo-visser-uitbehandeld-voor-zeldzame-vorm-van-lymfklierkanker-komt-alsnog-in-total-remissie-kankervrij-met-t-car-cel-immuuntherapie.html
31 augustus 2017: Lees ook dit artikel:
https://kanker-actueel.nl/NL/immuuntherapie-met-car-t-cell-therapy-tisagenlecleucel-kymriah-goedgekeurd-door-fda-voor-gebruik-bij-kinderen-en-jong-volwassenen-met-vorm-van-acute-lymfatische-leukemie-all.html
7 november 2015: lees het verhaal van Layla, een baby nog geen jaar oud die via immuuntherapie met T-cellen van een donor, T-cell enginering geheten, toegepast vlak voordat ze zou sterven, alsnog in een totale remissie kwam en nu al ruim dire maanden kankervrij is. Het verhaal van Layla met All - Acute Lymfatische Leukemie is wereldwijd overal gepubliceerd maar lees hier hoe de Volkskrant en Nature erover schrijven:
https://kanker-actueel.nl/NL/layla-een-baby-met-ongeneeslijke-vorm-van-all-acute-lymfatische-leukemie-lijkt-alsnog-te-genezen-door-immuuntherapie-met-t-cellen-van-een-donor-via-t-cell-enginering-therapie.html
16 juni 2015: Bron: 20th Congress of the European Hematology Association (EHA)
Een nieuwe studie en een update van een lopende studie, zie artikel hieronder, tonen aan dat een immuuntherapeutische aanpak met receptor-gemodificeerde T-cellen heel veel kinderen en volwassenen zou kunnen kan helpen alsnog in een totale remissie te komen van hun vorm van leukemie - Acute Lymfatische Leukemie. Toch krijgen nog weinig patiënten deze behandeling aangeboden terwijl de resultaten onvoorstelbaar goed zijn. Op het EHA dringen artsen erop aan, onder druk van patiënten en hun familie, dat deze aanpak beschikbaar zou moeten komen voor iedereen met ALL.
"Het overgrote deel van de patiënten met een recidief van ALL - Acute lymfatische leukemia (ALL), of hun familie willen een behandeling met gemodificeerde immuuncellen, zelfs nu dit nog steeds experimenteel is", aldus verschillende artsen op het 20th Congress van de European Hematology Association (EHA).
"De prognose voor deze patiënten is historisch gezien heel slecht," zegt Adriana Balduzzi, MD, from the Clinica Pediatrica Università degli Studi di Milano Bicocca in Milan.
Maar de eerste resultaten uit studies met chimeric antigen receptor (CAR) gemodificeerde T-cellen genetisch gerelateerd aan het B-cell-specific antigen CD19, geeft heel veel hoop voor deze groep van patiënten.
"De tot nu toe bekende studieresultaten geven hoop op een genezing voor sommige patiënten, waaronder ook kinderen, die, zoals het er nu voorstaat, geen enkele kans hebben hun ziekte te overleven," aldus Dr. Balduzzi.
CAR T-cell therapie zou goede resultaten kunnen geven in verschillende stadia van de ziekte, waaronder een onderhoudsbehandeling voor patiënten met een recidief of die nog geen stamceltransplantatie hebben gehad, alswel als een palliatieve behandeling voor patiënten met een minimale positieve residual disease (MRD) (toch weer blasten in bloed) op het moment van een stamceltransplantatie en als een preventieve behandeling voor patiënten. om te voorkomen dat ze MRD-positief worden na een stamceltransplantatie., aldus dr. Balduzzi.
Twee nieuwe studies:
At the EHA meeting, two research teams reported continuing impressive results in the treatment of refractory/relapsed ALL using CAR T-cells, including in a cohort of adults.
"We found that a high complete remission rate of 87% can be achieved in adult patients with refractory or relapsed B-cell ALL," said investigator Jae H. Park, MD, from the Memorial Sloan Kettering Cancer Center in New York City.
Patients with relapses of ALL have very poor prognoses. Overall 5-year survival rates are approximately 8%, according to recent studies; for patients older than 50 years, 5-year survival rates are even lower, at approximately 3%.
Interest in immunotherapy with CAR T-cells engineered to deliver a toxic blast to antigen-expressing tumor cells has been gaining for hematologic cancers.
The data presented by Dr Park involved patients with refractory or relapsed ALL, ranging in age from 18 to 74 years, who were treated with the therapy as of March 30. Of the cohort, 39 were evaluable for toxicity assessment and 38 were evaluable for response assessment with 1 month or more of follow-up.
Twenty-one of the patients had morphologic disease and 18 had MRD at the time of the CAR T-cell infusion.
After the infusion, 33 of 38 patients (87%) achieved complete remission, including 26 of 32 (81%) who were negative for MRD.
The median time to complete remission was 23 days (range, 8 - 46).
Of the 20 patients with morphologic disease, 16 (80%) achieved a complete remission and 87% were negative for MRD. Of the 18 patients with MRD, 17 achieved a complete remission (94%) and 76% were negative for MRD.
With a median follow-up of 5.6 months after infusion (range, 1 to at least 38 months), the median duration of response or relapse-free survival was 5.3 months (95% confidence interval, 3 - 9). Fourteen patients remained disease-free, including 10 patients who had not undergone allogeneic hematopoietic stem cell transplantation (HSCT) and six patients with more than 12 months of follow-up.
Eleven patients proceeded to allogeneic HSCT and 14 patients relapsed during follow-up, including three who had undergone HSCT and 10 who had not.
The median overall survival duration for all patients was 8.5 months, and the overall survival rate for patients at 6 months was 59%. For those with MRD, median overall survival was 10.8 months and the overall survival rate at 6 months was 75%.
Nine (23%) patients developed severe cytokine release syndrome (CRS) and required vasopressors and/or mechanical ventilation for hypoxia. Eleven (28%) patients developed grade 3/4 neurotoxicity, and three (8%) developed grade 5 toxicity.
Of the 21 patients with morphologic disease, nine (43%) had severe CRS, eight (38%) had grade 3/4 neurotoxicity, and two (10%) had grade 5 toxicity.
And of the 18 patients with MRD, none had severe CRS, three (17%) had grade 3/4 neurotoxicity, and one (6%) had grade 5 toxicity.
"We found that the severity of CRS correlated with disease burden," Dr Park reported. "CRS was managed with an IL-6R inhibitor in four patients, with steroids in two patients, and with an IL-6R inhibitor plus a steroid in nine patients."
The researchers are making progress in predicting which patients will develop CRS. "Predominantly, it has been patients with a large burden of disease," Dr Park said.
Meanwhile, the neurologic symptoms are reversible, he added.
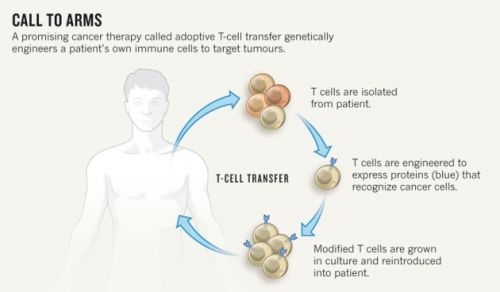
Pediatric Results Updated
Results from the largest cell therapy experience involving ALL reported to date were updated at the meeting by Shannon L. Maude, MD, PhD, from the Children's Hospital of Philadelphia.
This pediatric cohort has seen remarkable results. Initial results were published last year (N Engl J Med. 2014;371:1507-1517).
The update includes data on 48 patients, ranging in age from 4 to 22 years, all of whom had CD19-positive ALL.
Of this cohort, 38 patients had detectable disease prior to the infusion, 10 were negative for MRD, and 33 had relapsed after a previous stem cell transplantation.
One month after the infusion, 45 of 48 (94%) patients were in complete remission, and 42 patients had an MRD of less than 0.01% on flow cytometry.
Complete remission (85%) was achieved in 17 patients with more than 50% lymphoblasts in the bone marrow at infusion. In addition, at a median follow-up of 8 months (range, 1 - 36 months) as of April 26, 33 patients had ongoing complete remission, five of whom underwent subsequent stem cell transplantation.
Overall survival was 78% at 1 year, and 13 patients were in remission at 1 year, 10 without further therapy. Relapse occurred in 15 patients, including 10 with CD19-negative disease.
Nearly all patients (93%) developed CRS, and patients had dramatic elevations in ferritin, suggesting an association with macrophage activation syndrome.
Severe CRS requiring vasopressor or respiratory support occurred in 28% of patients. This rapidly resolved in each case, however, with patients responding to treatment with the anti-IL-6R agent tocilizumab.
Dr Park reports receiving research funding from Juno Therapeutics. Dr Balduzzi has disclosed no relevant financial relationships.
20th Congress of the European Hematology Association (EHA): Abstracts S111 and S112. Presented June 13, 2015.
11 december 2013: lees over dit onderwerp ook dit artikel: Immuuntherapie met gemanipuleerde T-cellen zorgt voor spectaculaire resultaten bij patiënten met vergevorderde vormen van leukemie - ALL, CLL, en lymfomen
1 april 2013: Bron: N Engl J Med. Published online March 25, 2013 en Sci Transl Med. 2013;5:177ra38.
Immuuntherapeutische aanpak met receptor-gemodificeerde T-cellen leidt tot totale remissies bij agressieve acute lymfatische leukemie (ALL) bij zowel kinderen als volwassenen en geven hoop dat deze aanpak een genezende behandeling kan worden, ook voor tot nu toe onbehandelbare vormen van leukemie. Zie ook artikel over blinatumomab bij ALL dat in feite zelfde aanpak is als deze aanpak.
De complete remissies werden bereikt in twee apart van elkaar uitgevoerde studies bij patiënten met een agressieve vorm van acute lymfatische leukemie (ALL), zowel bij kinderen als bij volwassenen. Alle patiënten hadden al uitputtend chemo en beenmergtransplantaties achter de rug maar kregen toch steeds weer een recidief. Zie verhaal van Shifra die hetzelfde overkwam, steeds in remissie kwam, maar helaas uiteindelijk toch haar gevecht tegen de leukemie verloor. In de studie met kinderen, gepubliceerd in de New England Journal of Medicine, chimeer antigen receptor-gemodificeerde T-cellen bewerkstelligden complete remissies bij 2 kinderen met een recidief van chemotherapie-refractieve ALL (red: Patiënten kregen ondanks de chemo toch een recidief) In de andere studie, gepubliceerd in Science Translational Medicine, 5 volwassenen (23 tot 66 jaar) met een recidief van een vorm van zogeheten B-cel gerelateerde acute lymfatische leukemie (ALL) werden behandeld met een andere vorm van genetisch gemodificeerde T-cellen. Alle 5 bereikten een complete remissie binnen 59 dagen na de behandeling, en 1 patiënt bereikte een complete remissie binnen 8 dagen na de behandeling.
Door deze remissies konden 4 van de 5 volwassenen door gaan met een behandeling met een allogene stamceltransplantatie, waarbij het doel om een blijvende genezing te bewerkstelligen groter is geworden door de T cel-therapie aldus hoofdonderzoeker Renier J. Brentjens, MD, PhD, van het Memorial Sloan-Kettering Cancer Center in New York City.
Van de 2 kinderen die een totale remissie bewerkstelligen is er 1 kind nog steeds in leven en 1 kind is overleden. Een 7-jarig meisje is 11 maanden na de behandeling met een intraveneus infuus van de gemodificeerde T-cellen nog steeds in leven en er lijken nog steeds geen kankercellen in haar lichaam aanwezig te zijn. Een 10-jarig meisje, die ook een complete remissie bewerkstelligde, kreeg na twee maanden een terugval met een recidief met een vorm van leukemie cellen met andere receptoren die niet reageerden op de op eerdere op bepaalde receptor gerichte behandeling. Zij is later overleden. Aldus hoofd van dit onderzoek Stephan Grupp, MD, PhD, directeur van translationeel onderzoek bij het Center for Childhood Cancer Research, The Children's Hospital van Philadelphia en professor in de kindergeneeskunde aan de Perelman School of Medicine, University of Pennsylvania.
Het onderzoek van dr. Grupp:
De T-cellen die het Dr Grupp team gebruikte werden van elk individueel kind afgenomen en gemodificeerd om een zogeheten chimeer type antigen-receptor cel - CTL019 te maken. (red: dit lijkt veel op dendritische celtherapie maar nu worden de dendritische cellen bewust bewerkt - gemodificeerd gericht op een bepaald eiwit)
Deze cellen zoeken en vernietigen CD19 eiwit op het oppervlak van bepaalde B-cellen van de leukemiecellen en doden daarmee ook de leukemiecellen als geheel. Het unieke van deze CTL019 cellen is dat wanneer ze worden teruggegeven aan de patiënt (door middel van een intraveneus infuus), ze zich met duizenden vermenigvuldigen. Belangrijk is dat
ze voor zeer lange tijd in het lichaam blijven bestaan, aldus Dr Grupp.
"In de meeste studies tot op heden zijn de T-cellen in de patiënt gebracht en er gebeurde niet zoveel - de cellen groeiden niet veel - misschien wel omdat de cellen aan het eind van hun levensduur waren .... Wat opvallend anders is aan onze aanpak is dat deze gemodificeerde cellen zich erg sterk vermenigvuldigden, tot aan het 10.000-voudige aan toe," zegt Dr Grupp
Echter, terwijl de CTL019 cellen de leukemiecellen elimineren, kunnen ze ook een overactieve immuunrespons genereren, of het zogeheten cytokine release syndroom, waardoor een gevaarlijk hoge koorts, lage bloeddruk en griepachtige symptomen ontstaan bij de patiënt. Dit gebeurde bij het kind van 7. "Ze werd erg ziek en kwam op de intensive care terecht. Bij een bloedanalyse vonden we dat haar interleukine -6 [IL-06] sterk was verhoogd.".
De behandelend artsen besloten gebruik te maken van tocilizumab, een medicijn ontwikkeld voor reumatoïde artritis, dat specifiek gericht is op IL-6, en binnen een paar uur, verdwenen de ernstigste symptomen."
"Het was absoluut verbazingwekkend. We gaven het haar in de avond en al snel na inname was haar koorts weg, haar zuurstofbehoefte verdween 's nachts, en haar bloeddruk problemen verdwenen. Ze herstelde volledig in zeer korte tijd.
Het is duidelijk dat we geleerd hebben van de behandeling van dit meisje, dat een medicijn gericht tegen IL-6 de toxiciteit kan wegnemen zonder te interfereren met de T-cellen die de leukemiecellen doden. De T-cellen deden hun ding, zelfs nadat we het meisje hadden behandeld met een medicijn die deze IL-6 blokkade opriep." zegt Dr Grubb.
"Bij het tweede kind bleken een klein aantal van haar B-cellen niet expliciet een CD19 expressie te hebben, of met een erg lage CD19 expressie. Doordaar werden deze leukemiecellen niet door de gemodificeerde T-cellen gezien. Het meisje kwam nog wel in een complete remissie, maar kreeg een recidief door de leukemiecellen die geen CD19 op hun oppervlak hadden," zegt Dr. Grupp.
Over het geheel genomen blijkt de huidige aanpak van B-cel gerelateerde ALL met chemo goed te werken. Zowel dr. Grupp als dr. Brentjens benadrukken dat deze T-cel behandelingen in eerste instantie alleen worden onderzocht voor die patiënten waarbij chemo en beenmergtransplantatie en stamceltrransplantatie niet werkt. Dr. Brentjens zijn groep gaat daarin het minst ver want als de aanpak met de T-cellen aanslaat en er een remissie wordt bewerkstelligd, volgt alsnog een beenmergtransplantatie. Hun aanpak is dus meer gericht om een beenmergtransplantatie betere kansen te geven. Terwijl de groep van dr. Grupp voor een direct genezende aanpak met de T-cellen gaat. Bovenstaande heb ik grotendeels gemaakt en vertaald uit een artikel van Medscape in combinatie met de originele studierapporten.
Het volledige studierapport Chimeric Antigen Receptor–Modified T Cells for Acute Lymphoid Leukemia in het N Engl J Med. is gratis in te zien. Het andere studierapport: CD19-Targeted T Cells Rapidly Induce Molecular Remissions in Adults with Chemotherapy-Refractory Acute Lymphoblastic Leukemia gepubliceerd in Sci Transl Med. 2013 is alleen tegen betaling in te zien.
Hier de respectievelijke abstracten:
Chimeric Antigen Receptor–Modified T Cells for Acute Lymphoid Leukemia
Stephan A. Grupp, M.D., Ph.D., Michael Kalos, Ph.D., David Barrett, M.D., Ph.D., Richard Aplenc, M.D., Ph.D., David L. Porter, M.D., Susan R. Rheingold, M.D., David T. Teachey, M.D., Anne Chew, Ph.D., Bernd Hauck, Ph.D., J. Fraser Wright, Ph.D., Michael C. Milone, M.D., Ph.D., Bruce L. Levine, Ph.D., and Carl H. June, M.D.
March 25, 2013DOI: 10.1056/NEJMoa1215134
Chimeric antigen receptor–modified T cells with specificity for CD19 have shown promise in the treatment of chronic lymphocytic leukemia (CLL). It remains to be established whether chimeric antigen receptor T cells have clinical activity in acute lymphoblastic leukemia (ALL). Two children with relapsed and refractory pre–B-cell ALL received infusions of T cells transduced with anti-CD19 antibody and a T-cell signaling molecule (CTL019 chimeric antigen receptor T cells), at a dose of 1.4×106 to 1.2×107 CTL019 cells per kilogram of body weight. In both patients, CTL019 T cells expanded to a level that was more than 1000 times as high as the initial engraftment level, and the cells were identified in bone marrow. In addition, the chimeric antigen receptor T cells were observed in the cerebrospinal fluid (CSF), where they persisted at high levels for at least 6 months. Eight grade 3 or 4 adverse events were noted. The cytokine-release syndrome and B-cell aplasia developed in both patients. In one child, the cytokine-release syndrome was severe; cytokine blockade with etanercept and tocilizumab was effective in reversing the syndrome and did not prevent expansion of chimeric antigen receptor T cells or reduce antileukemic efficacy. Complete remission was observed in both patients and is ongoing in one patient at 11 months after treatment. The other patient had a relapse, with blast cells that no longer expressed CD19, approximately 2 months after treatment. Chimeric antigen receptor–modified T cells are capable of killing even aggressive, treatment-refractory acute leukemia cells in vivo. The emergence of tumor cells that no longer express the target indicates a need to target other molecules in addition to CD19 in some patients with ALL. Read the full study report>>>>>
CD19-Targeted T Cells Rapidly Induce Molecular Remissions in Adults with Chemotherapy-Refractory Acute Lymphoblastic Leukemia
Sci Transl Med 20 March 2013:
Vol. 5, Issue 177, p. 177ra38
Sci. Transl. Med. DOI: 10.1126/scitranslmed.3005930
CD19-Targeted T Cells Rapidly Induce Molecular Remissions in Adults with Chemotherapy-Refractory Acute Lymphoblastic Leukemia
- Renier J. Brentjens1,2,3,*,†,
- Marco L. Davila1,†,
- Isabelle Riviere1,2,3,4,†,
- Jae Park1,
- Xiuyan Wang3,4,
- Lindsay G. Cowell5,
- Shirley Bartido4,
- Jolanta Stefanski4,
- Clare Taylor4,
- Malgorzata Olszewska4,
- Oriana Borquez-Ojeda4,
- Jinrong Qu4,
- Teresa Wasielewska4,
- Qing He4,
- Yvette Bernal1,
- Ivelise V. Rijo6,
- Cyrus Hedvat6,
- Rachel Kobos7,
- Kevin Curran7,
- Peter Steinherz7,
- Joseph Jurcic1,
- Todd Rosenblat1,
- Peter Maslak1,
- Mark Frattini1 and
- Michel Sadelain1,2,3,*
+ Author Affiliations
- 1Department of Medicine, Memorial Sloan-Kettering Cancer Center, New York, NY 10065, USA.
- 2Center for Cell Engineering, Memorial Sloan-Kettering Cancer Center, New York, NY 10065, USA.
- 3Molecular Pharmacology and Chemistry Program, Memorial Sloan-Kettering Cancer Center, New York, NY 10065, USA.
- 4Cell Therapy and Cell Engineering Facility, Memorial Sloan-Kettering Cancer Center, New York, NY 10065, USA.
- 5Department of Clinical Sciences, UT Southwestern, Dallas, TX 75390, USA.
- 6Department of Pathology, Memorial Sloan-Kettering Cancer Center, New York, NY 10065, USA.
- 7Department of Pediatrics, Memorial Sloan-Kettering Cancer Center, New York, NY 10065, USA.
+ Author Notes
- ↵*Corresponding author. E-mail: brentjer@mskcc.org (R.B.); m-sadelain@ski.mskcc.org (M.S.)
Adults with relapsed B cell acute lymphoblastic leukemia (B-ALL) have a dismal prognosis. Only those patients able to achieve a second remission with no minimal residual disease (MRD) have a hope for long-term survival in the context of a subsequent allogeneic hematopoietic stem cell transplantation (allo-HSCT). We have treated five relapsed B-ALL subjects with autologous T cells expressing a CD19-specific CD28/CD3ζ second-generation dual-signaling chimeric antigen receptor (CAR) termed 19-28z. All patients with persistent morphological disease or MRD+ disease upon T cell infusion demonstrated rapid tumor eradication and achieved MRD− complete remissions as assessed by deep sequencing polymerase chain reaction. Therapy was well tolerated, although significant cytokine elevations, specifically observed in those patients with morphologic evidence of disease at the time of treatment, required lymphotoxic steroid therapy to ameliorate cytokine-mediated toxicities. Indeed, cytokine elevations directly correlated to tumor burden at the time of CAR-modified T cell infusions. Tumor cells from one patient with relapsed disease after CAR-modified T cell therapy, who was ineligible for additional allo-HSCT or T cell therapy, exhibited persistent expression of CD19 and sensitivity to autologous 19-28z T cell–mediated cytotoxicity, which suggests potential clinical benefit of additional CAR-modified T cell infusions. These results demonstrate the marked antitumor efficacy of 19-28z CAR-modified T cells in patients with relapsed/refractory B-ALL and the reliability of this therapy to induce profound molecular remissions, forming a highly effective bridge to potentially curative therapy with subsequent allo-HSCT.
- Copyright © 2013, American Association for the Advancement of Science
CAR engineerd, CD19, immuuntherapie, T-cellen, Shifra, Acute Lymfatische Leukemie, ALL, leukemie, Layla, donor T-cellen
Gerelateerde artikelen





Plaats een reactie ...
1 Reactie op "Receptor-gemodificeerde T-cellen leiden tot totale remissies bij uitbehandelde agressieve acute lymfatische leukemie - ALL en geven hoop op genezende behandeling. copy 1"