Mocht u kanker-actueel de moeite waard vinden en ons willen ondersteunen om kanker-actueel online te houden dan kunt u ons machtigen voor een periodieke donatie via donaties: https://kanker-actueel.nl/NL/donaties.html of doneer al of niet anoniem op - rekeningnummer NL79 RABO 0372931138 t.n.v. Stichting Gezondheid Actueel in Amersfoort. Onze IBANcode is NL79 RABO 0372 9311 38
Elk bedrag is welkom. En we zijn een ANBI instelling dus uw donatie of gift is in principe aftrekbaar voor de belasting.
En als donateur kunt u ook korting krijgen bij verschillende bedrijven:
22 april 2017: Bron: Pediatr Blood Cancer. 2009 Jan; 52(1): 44–50
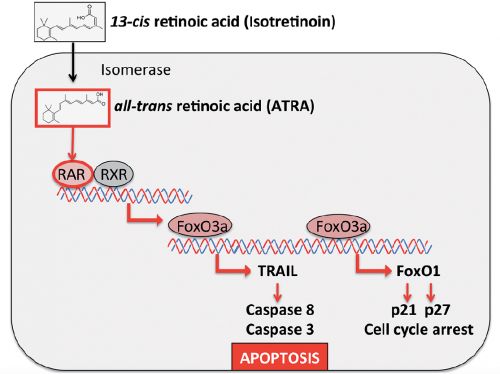
Wanneer kinderen met een neuroblastoom graad 3 en 4 na een intensive chemokuur met een zogeheten Myeloablatieve Therapie aanvullend verder worden behandeld met 13-cis-Retinoïnezuur (ook wel bekend onder ATRA, zie o.a. hoe ATRA kinderen met bepaalde vorm van leukemie (APL) volledig kan genezen) dan stijgen de kansen op een overall overleving met tientallen procenten tot 100 procent op een vijf jaars meting voor de 6 patienten die een volledige behandeling kregen en wilden. Daarbij opgemerkt dat nog al wat kinderen door hun ouders werden teruggetrokken uit de studie. Omdat een neuroblastoom relatief niet zo vaak voorkomt is het sowieso heel moeilijk om daar onderzoek naar te doen met grote aantallen patiënten.
Daarom zijn deze resultaten, hoewel duidelijk veel beter dan een standaard behandeling, statistisch niet significant. Maar als we de resultaten nader bekijken van deze gerandomiseerde studie, ook die van de groep patienten die alleen 13-cis-Retinoïnezuur kregen was duidelijk beter dan die uit de controlegroep die geen verdere behandeling kregen of wilden, dan pleit alles ervoor om toch te behandelen met 13-cis-Retinoïnezuur.
Tekst gaat onder grafiek verder
Studieresultaten:
De 5-jaar ziektevrije tijd (EFS) en overall overleving (OS) voor patiënten met stadium 3 neuroblastomen waren respectievelijk (zie ook tabel 4 hieronder):
- Voor alle patiënten was de ziektevrije tijd (EFS) 55 +/- 6% en overall overleving (OS) 59% +/- 6%, (n=72).
- Patiënten die waren ingedeeld in de groep voor alleen een Myeloablatieve Therapie - ABMT (n=20) hadden een ziektevrije tijd (EFS) op 5 jaar van 65% +/- 11% en een overall overleving (OS) van 65% +/- 11% vergeleken met respectievelijk een EFS van 41% +/- 11 (p=0.21) en OS van 46% +/- 11% (p=0.23) voor patienten gerandomiseerd ingedeeld in de controlegroep (n=23).
- Patiënten gerandomiseerd ingedeeld voor een behandeling met alleen 13-cis-Retinoïnezuur (n=23) hadden een 5 jaars EFS van 70% +/- 10% en OS van 78% +/- 9% vergeleken met respectievelijk EFS van 63% +/- 12% (p=0.67) en OS van 67% +/- 12% (p=0.55) voor diegenen (n=16) die geen verdere behandeling kregen of wilden.
- Patiënten gerandomiseerd ingedeeld naar zowel ABMT als 13-cis-Retinoïnezuur (n=6) hadden een EFS op 5 jaar van 80% ± 11% en OS van 100%.
Tekst gaat onder grafiek verder
Table IV
Survival rates by response to induction chemotherapy: overall and within treatment group.
| Characteristic | n | 5-year EFS rate ± std error | p-value# | 5-year OS rate ± std error | p-value# |
|---|---|---|---|---|---|
| Overall | |||||
| CR/VGPR | 45 | 66% ± 8% | 0.0043 | 70% ± 8% | 0.0081 |
| ≤ PR | 19 | 26% ± 11% | 30% ± 13% | ||
| CC patients | |||||
| CR/VGPR | 10 | 56% ± 19% | 0.1029 | 65% ± 19% | 0.1562 |
| ≤ PR | 9 | 22% ± 14% | 25% ± 13% | ||
| Unknown | 4 | ||||
| ABMT patients | |||||
| CR/VGPR | 15 | 73% ± 12% | 0.1728 | 73% ± 12% | 0.1221 |
| ≤ PR | 4 | 25% ± 22% | 25% ± 22% | ||
| Unknown | 1 | ||||
| NRCC patients | |||||
| CR/VGPR | 18 | 67% ± 12% | 0.1625 | 72% ± 12% | 0.3503 |
| ≤ PR | 6 | 33% ± 27% | 40% ± 31% | ||
| Unknown | 2 | ||||
| 13-cis-RA patients | |||||
| CR/VGPR | 16 | 69% ± 12% | 0.9280 | 81% ± 11% | 0.6589 |
| ≤ PR | 5 | 60% ± 22% | 60% ± 19% | ||
| No 13-cis-RA patients | |||||
| CR/VGPR | 10 | 80% ± 16% | 0.0195 | 79% ± 16% | 0.1025 |
| ≤ PR | 4 | 25% ± 22% | 38% ± 30% | ||
| NR 13-cis-RA patients | |||||
| CR/VGPR | 3 | (2 events) | NA | (2 died) | NA |
| ≤ PR | 1 | (1 event) | (1 died) | ||
CC=randomized to chemotherapy only; ABMT=randomized to myeloablative chemotherapy followed by autologous bone marrow transplantation; NRCC=non-randomly assigned to chemotherapy only; 13-cis-RA=randomized to 13-cis-retinioc acid; No 13-cis-RA=randomized to no 13-cis-retinioc acid; NR 13-cis-RA=non-randomly assigned to 13-cis-retinioc acid.
De onderzoekers schrijven een algemene conclusie over deze studie die ik geprobeerd heb te vertalen met google translation, maar heb de originele conclusie ook erbij geplaatst zodsat u deze ook zelf kunt lezen. Daar onder staat het het abstract en link naar het volledige studie verslag.
DISCUSSION - Discussie
Een neuroblastoom stadium 3 is een heterogene groep van tumoren met een significante variabiliteit in de uitkomst. Onze gegevens bevestigen een algehele slechte uitkomst voor een stadium 3 ziekte en een hoog risico. De kleine aantallen van de patiënten met een stadium 3 die zijn ingeschreven in de CCG-3891 studie beperken ons vermogen om een statistisch significant verschil tussen behandelingsgroepen op te sporen. Echter, de gegevens ondersteunen verder onderzoek om de werkzaamheid van myeloablatieve consolidatie therapie beter voor te stellen voor patiënten met een verhoogd risico en stadium 3 neuroblastoom.
Stage 3 neuroblastoma is a hetergenous group of tumors with significant variability in outcome. Our data confirm an overall poor outcome for Stage 3 disease and high risk features. The small numbers of Stage 3 patients enrolled onto the CCG-3891 study limit our ability to detect a statistically significant difference between treatment groups. However, the data support further investigation to better delineate the efficacy of myeloablative consolidation therapy for patients with high risk Stage 3 neuroblastoma.
De aanwezigheid van het MYCN-gen met verhoogde expressie in een neuroblastoom is een krachtige voorspeller van het resultaat, dat onafhankelijk is van anatomische stadium-, leeftijd- en tumorhistopathologie. [8,9] Er bestaat een statistisch slechtere ziektevrije tijd (EFS) en overall overleving (OS) voor patiënten met fase 3 MYCN neuroblastoom (p <0,0001). De kleine aantallen gerandomiseerde patiënten met een neuroblastoom stadium 3 met een MYCN verhoogde expressie beperken ons vermogen om een statistisch significante verbetering te identificeren na ABMT. Toch suggereren zowel de CCG-3891 als de Duitse Society of Pediatric Oncology and Hematology NB97 studie, een voordeel van ABMT voor patiënten met MYCN-versterkte neuroblastoom [2,10]. Deze gegevens en de algehele slechte prognose voor MYCN versterkte stadium 3 neuroblastoom ondersteunen het gebruik van ABMT consolidatie voor patiënten met stadium 3 MYCN versterkte neuroblastoom.
The presence of MYCN gene amplification within neuroblastoma is a powerful predictor of outcome independent of anatomic stage, age and tumor histopathology.[8,9] A statistically worse EFS and OS exists for patients with Stage 3 MYCN amplified neuroblastoma (p < 0.0001). The small numbers of randomized patients with Stage 3 MYCN amplified neuroblastoma limit our ability to identify a statistically significant improvement following ABMT. Yet both the CCG-3891 and the German Society of Pediatric Oncology and Hematology NB97 trials suggest a benefit of ABMT for patients with MYCN amplified neuroblastoma[2,10]. These data and the overall poor prognosis for MYCN amplified Stage 3 neuroblastoma support the use of ABMT consolidation for patients with Stage 3 MYCN amplified neuroblastoma.
Patiënten met een slechte respons op inductie chemotherapie hebben meer kans op een minimale restziekte, ondanks ABMT, zoals blijkt uit hun hogere recidiefkansen. Daarentegen had de subgroep van patiënten met een slechte respons op inductie chemotherapie die vervolgens 13-cis-Retinoïnezuur (n = 5) kregen een uitstekende overleving. Kleine patiënten aantallen beperken statistische significantie, maar suggereren dat 13-cis-Retinoïnezuur gunstig kan zijn bij het richten op minimale residuele ziekte die na myeloablatieve therapie blijft. De eerder gemelde analyse voor alle patiënten (fase 3 en 4 gecombineerd) ingeschreven in de CCG-3891 studie ondersteunen deze hypothese verder. [2]
Patients with poor response to induction chemotherapy are more likely to have minimal residual disease despite ABMT, as evidenced by their higher relapse rate. In contrast, the subgroup of patients with poor response to induction chemotherapy who subsequently received 13-cis-RA (n=5) had an excellent survival. Small patient numbers limit statistical significance but suggest that 13-cis-RA may be beneficial in targeting minimal residual disease that remains after myeloablative therapy. The previously reported analysis for all patients (stage 3 and 4 combined) enrolled onto CCG-3891 further supports this hypothesis.[2]
Neuroblastoom histopathologische classificatie heeft prognostische waarde in alle ziektestadia, onafhankelijk van MYCN-genversterking. [3,11] De kleine steekproefgrootte van onze proef beperkt de mogelijkheid om een statistisch significante prognostische waarde van histologie te detecteren. We hebben een overall overleving (OS) van 70% waargenomen bij patiënten die > 18 maanden oud zijn bij de diagnose van fase 3 neuroblastoom zonder MYCN genversterking, maar met ongunstige histopathologie. Dit is zeker minder dan de overall overleving (OS) van 85-90% die eerder is gerapporteerd voor patiënten met stadium 3 neuroblastoom > 2 jaar met gunstige biologische eigenschappen, waaronder gunstige histologie. [1] In tegenstelling tot patiënten die <18 maanden oud zijn met MYCN niet-geamplificeerde fase 3 tumoren die behandeld worden in de studie CCG 3891, hebben een uitstekende prognose (n = 7, OS 100%), vergelijkbaar met de uitstekende prognose die wordt aangetoond voor patiënten tot 18 maanden Gediagnosticeerd met biologisch gunstig stadium 4 neuroblastoom. [12,13] Deze gegevens suggereren dat een vermindering van de therapeutische dosisintensiteit en het elimineren van myeloablatieve therapie bij patiënten jonger dan 18 maanden met stadium 3, MYCN niet-versterkte neuroblastoom, ongeacht histopathologie moet worden overwogen.
Neuroblastoma histopathologic classification has prognostic value across all disease stages, independent of MYCN gene amplification.[3,11] The small sample size of our trial limit the ability to detect a statistically significant prognostic value of histology. We observed an OS of only 70% for patients who are > 18 months of age at diagnosis of Stage 3 neuroblastoma without MYCN gene amplification, but with unfavorable histopathology. This is notably less than the survival of 85-90% previously reported for patients with Stage 3 neuroblastoma > 2 years of age with favorable biologic features including favorable histology.[1] In contrast, patients < 18 months of age with MYCN non-amplified Stage 3 tumors treated on CCG 3891, have an excellent prognosis (n=7, OS 100%), similar to the excellent prognosis demonstrated for patients up to 18 months of age diagnosed with biologically favorable stage 4 neuroblastoma.[12,13] These data suggest that reduction in therapeutic dose intensity and eliminating myeloablative therapy for patients less than 18 months of age with Stage 3, MYCN nonamplified neuroblastoma, regardless of histopathology should be considered.
Ondanks de prognostische waarde, is MYCN-amplificatie alleen aanwezig in 30% van de neuroblastomtumoren, waardoor een significant deel van de hoog risico patiënten niet kan worden geïdentificeerd met behulp van genomische evaluatie. Het verlies van heterozygoziteit (LOH) bij chromosomen 1p en 11q heeft een prognostische betekenis, onafhankelijk van MYCN-amplificatie [5,14-16]. Door de beperkte tumorgenetische gegevens die beschikbaar zijn, zijn we helaas niet in staat om een prognostische betekenis van deze genetische factoren aan te tonen voor een stadium 3 ziekte. De algehele slechte ziektevrije tijd (EFS) bij patiënten stadium 3 met hoge risicofuncties ondersteunt de noodzaak van voortgezette toekomstige evaluatie van deze genetische factoren.
Despite its prognostic value, MYCN amplification is only present in 30% of neuroblastoma tumors leaving a significant proportion of high-risk patients that can not be uniquely identified using genomic evaluation. The loss of heterozygozity (LOH) at chromosomes 1p and 11q have prognostic significance independent of MYCN amplification,[5,14-16] Unfortunately, due to the limited tumor genetic data available, we remain unable to demonstrate a prognostic significance of these genetic factors for Stage 3 disease. The overall poor EFS in stage 3 patient with high risk features supports the need for continued prospective evaluation of these genetic factors.
Er is nog steeds behoefte aan nieuwe therapieën om de overleving voor stadium 3 neuroblastoom te verbeteren met MYCN-versterking, ongunstige histopathologie bij die patienten van > 18 maanden of met een slechte response op de initiële therapie. Onze gegevens, samen met de eerder gepubliceerde CCG-3891 gegevens, ondersteunen het gebruik van agressieve consolidatie therapie, waaronder ABMT voor deze subgroep van de hoog risico stadium 3 patiënten. Het optreden van een uitgezaaid recidief bij stadium 3 neuroblastoom bevestigt de aanwezigheid van minimale residuele ziekte en geeft een reden voor het gebruik van 13-cis-RA na consolidatie ABMT. We waren niet in staat om een statistisch significante verbetering van de overleving te demonstreren voor die stadium 3 patiënten die gerandomiseerd werden om 13-cis-Retinoïnezuur te ontvangen, misschien door de kleine aantallen van de stadium 3 patiënten die deelnamen aan de 13-cis-Retinoïnezuur behandelingsgroep. Verdere onderzoeken zijn gepland om nieuwe inductie regimes te testen die niet-kruisbestendige chemotherapeutische of biologisch gerichte middelen omvatten, uniform gebruik van radiotherapie op de primaire tumorplaats en nieuwe behandeling van minimaal residuele ziekte
There remains a need to develop new therapies to improve survival for stage 3 neuroblastoma with MYCN amplification, unfavorable histopathology in those > 18 months of age or with poor response to initial therapy. Our data, together with the previously published CCG-3891 data provide support for the use of aggressive consolidation therapy including ABMT for this subset of the high risk Stage 3 patients. The occurrence of metastatic relapse in Stage 3 neuroblastoma confirms the presence of minimal residual disease and provides rationale for the use of 13-cis-RA following consolidation ABMT. We were not able to demonstrate a statistically significant improvement in survival for those Stage 3 patients randomized to receive 13-cis-RA, perhaps due to the small numbers of stage 3 patients who participated in the 13-cis-RA randomization. Further investigations are planned to test novel inductions regimens that incorporate non-cross resistant chemotherapeutic or biologically-targeted agents, uniform use of radiotherapy to the primary tumor site and novel treatment of minimal residual disease.
Het volledige studierapport: Outcome of High-Risk Stage 3 Neuroblastoma with Myeloablative Therapy and 13-cis-Retinoic Acid: A Report from the Children’s Oncology Group is gratis in te zien.
Hier het abstract van deze studie met referentielijst:
Patients with high-risk Stage 3 neuroblastoma have an overall poor prognosis despite aggressive chemoradiotherapy. Further studies are warranted to determine if myeloablative consolidation followed by 13-cis-RA maintenance therapy statistically significantly improves outcome.
Outcome of High-Risk Stage 3 Neuroblastoma with Myeloablative Therapy and 13-cis-Retinoic Acid: A Report from the Children’s Oncology Group
Gerelateerde artikelen
- ESMO 2023: aanbevolen abstracten voor hersentumoren en neuro oncology door oncologen en wetenschappers
- ASCO 2023: aanbevolen abstracten gerelateerd aan de ziekte van Von Hippel-Lindau en disease–associated central nervous system (CNS) door wereldwijd bekende artsen en oncologen copy 1
- FDA - Food and Drug Administration geeft versnelde goedkeuring aan naxitamab plus Granulocyte Macrophage Colony Stimulating Factor (GM-CSF) voor hoog-risico neuroblastoom in het bot of het beenmerg
- Patienten met een hersentumor, type Glioblastoma en anaplastisch astrocytoma, met een EGFRvIII mutatie lijken baat te hebben met AMG 595, 47 procent bereikte stabiele ziekte
- Avastin - Bevacizumab toegevoegd aan chemo (Temozolomide - Temodal) faalt en geeft zelfs slechtere overall overleving op 1 jaar bij een behandeling van een hersentumor Glioblastoma
- Bestraling - radiotherapie bij hersentumoren: een aantal artikelen bij elkaar gezet.
- Biomoleculair profiel van laaggradige hersentumoren - astrocytomas, oligodendrogliomas en oligoastrocytomas - ontrafelt en bepaalde mutaties geven duidelijke prognose op overlevingskansen
- Biomoleculair profile onderzoek bij hersentumoren - glioblastoma multiforme maakt wezenlijk verschil in behandelingsresultaten blijkt uit twee studies copy 1
- Chemo bij hersentumoren: een overzicht van recente ontwikkelingen en artikelen, met name over Temodal - Temolzolomide
- Dendritische celtherapie vooral ook succesvol toepasbaar bij hersentumoren copy 1
- Erlotinib:- Tarceva werkt niet bij Glioblastoma Multiforme blijkt uit Europese gerandomiseerde fase II studie (ruim 100 deelnemers). Slechts 11 procent haalt 6 maandengrens van overleving.
- Erfelijke neuroblastoom (hersentumoren) blijkt te genezen te kunnen worden met ALK medicijn gebaseerd op de specifieke kiembaan mutatie ALK R1275Q mutatie copy 1
- Glioblastoom behandelingen: verleden, heden en toekomst. Overzichtstudie van hoe hersentumoren van het type Glioblastoma te behandelen. Van diagnose via DNA en genmutaties tot vormen van immuuntherapie
- Hersenmetastases: Hardnekkige misvattingen over behandelen van uitzaaiingen in het hoofd - de hersenen (chirurgie en/of radiotherapie) maken dat veel patiënten verkeerd worden behandeld en heeft grote gevolgen voor therapeutisch effect.
- Hersentumoren en dendritische celtherapie: een overzicht van recente ontwikkelingen en belangrijke studies copy 1
- Immuuntherapie bij hersentumoren met vaccins en virussen waaronder Newcastle Disease Virus. Een overzicht van recente ontwikkelingen. copy 1
- Kytogeen dieet naast chemo en bestraling bij hersentumoren wordt in fase II studie onderzocht in Erasmus medisch centrum copy 1
- Methadon: Wordt methadon (D,L-Methadone) aanvullend op chemo (temozolomide) en bestraling de genezende behandeling voor hersentumoren type glioblastoma?
- Monoterpene perillyl alcohol een natuurlijk middel verlengt overall overleving en ziektevrije tijd bij hersentumoren Glioblastoma hoog significant, vooral bij recidief van glioblastoma copy 1
- Neuroblastoom: 13-cis Retinoinezuur aanvullend gegeven naast en na chemo en myeloablatieve therapie (ABMT) verbetert de langjarige overall overleving van kinderen met een Neuroblastoom graad 3 en 4 tot 100 procent op 5 jaars meting
- Neuroblastomen: Lage dosis primaire chemotherapie plus stamceltransplantatie zorgt voor goede resultaten bij kinderen met lokaal inoperabele neuroblastoom, 27,2 % overleeft de 10 jaar
- NOVO TFF-100A is een niet toxische electroden aanpak van hersentumoren en geeft spectaculair betere resultaten dan chemo.
- ONC201 verdubbelt overleving van kinderen met diffuus middellijnglioom (DMG) of diffuus intrinsiek ponsglioom (DIPG) en ONC201 wordt nu onderzocht bij alle patienten met deze vormen van hersentumoren
- Operaties bij hersentumoren: hier een aantal artikelen over recente ontwikkelingen in chirurgie bij hersentumoren bij elkaar gezet.
- Ultra Sound: Geluidsgolven die bloed-hersenbarriëre openen geven langere overleving bij patiënten met hersentumoren van het type Glioblastoom
- PDT - Foto Dynamische Therapie voor hersentumoren: een overzicht van artikelen en recente ontwikkelingen. Scroll in linkerkolom voor artikelen. Update 27 maart 2010
- FET-PET scan met radio actief gelabelde amino zuren verbetert significant diagnose en uiteindelijk ook effect van behandelingen van hersentumoren in vergelijking met de MET scan
- Valgancyclovir toegevoegd aan temozolomide plus bestraling bij hersentumoren glioblastoma verbetert overall overleving met 11 maanden
- VORASIDENIB geeft verdubbeling van progressievrije ziekte (27 vs 11 maanden) bij patienten met een laaggradige hersentumor type oligodendroglioom of astrocytoom met een IDH1/2-mutatie in vergelijking met placebo
- Xerecept blijkt beter en geeft minder bijwerkingen dan dexamethason als aanvulling bij behandelingen van hersentumoren.
- Reguliere oncologie: een overzicht van recente ontwikkelingen en belangrijke studies in de reguliere oncologie



Plaats een reactie ...
Reageer op "Neuroblastoom: 13-cis Retinoinezuur aanvullend gegeven naast en na chemo en myeloablatieve therapie (ABMT) verbetert de langjarige overall overleving van kinderen met een Neuroblastoom graad 3 en 4 tot 100 procent op 5 jaars meting"