6 januari 2016: Bron: AvL Amsterdam en clinical trials
De bekendmaking van het behandelen van melanoom met een gemoduleerd virus (Talimogene Laherparepvec (T-VEC) geheten) blijkt eigenlijk oud nieuws en geen nieuwe studie. Al jaren is onderzoek gedaan naar deze vorm van immuuntherapie, zie o.a. dit studierapport: Patterns of Clinical Response with Talimogene Laherparepvec (T-VEC) in Patients with Melanoma Treated in the OPTiM Phase III Clinical Trial.
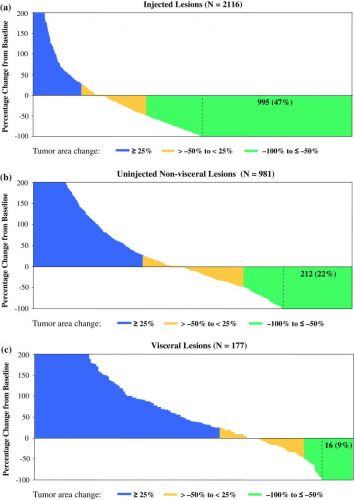
Hier een grafiek van resultaten uit bovenstaande studie:
Tekst gaat verder onder grafiek
De conclusie uit bovenstaande studie:
T-VEC demonstrates response in injected and uninjected lesions, and represents a new first-in-class oncolytic virus immunotherapy for patients with melanoma. These data also suggest that, similar to other novel immunotherapies, more patients may have benefited from treatment with T-VEC due to the delayed nature of tumor regression. Opportunities to enhance T-VEC activity could include direct injection of visceral lesions and/or combination with immune checkpoint inhibitors. Early reports from a phase Ib clinical trial of T-VEC and ipilimumab suggest a response rate of 56 % and a CR rate of 33 %; a randomized phase II study is ongoing.16 Future studies will likely focus on defining the specific mechanisms by which T-VEC mediates tumor regression and the development of rational combination therapies to improve the potential of this agent for patients with cancer, in both melanoma and other tumors.
Onderaan dit artikel het abstract van deze studie met referentielijst waarin meerdere studies met immuuntherapie met Talimogene Laherparepvec (T-VEC).
Het studie protocol van de lopende studie met Talimogene Laherparepvec (T-VEC) in het Anthonie van Leeuwenhoek ziekenhuis staat hier: https://www.clinicaltrialsregister.eu/ctr-search/trial/2013-005552-15/NL
5 januari 2017: Bron NPO journaal van 18.00 d.d. 5 januari 2017
Ik kom hier later op terug maar zag net het item waarin een oncoloog van het Anthonie van Leeuwenhoek vertelt hoe zij succesvol melanoompatienten behandelen met een gemoduleerd herpesvirus dat normaal gesproken koortslippen veroorzaakt. Zie hier het item net voor het weerbericht: http://www.npo.nl/live/npo-1
Meer over immuuntherapie met gemoduleerde virussen staat o.a. hier op kanker-actueel en zie daar in gerelateerde artikelen:
https://kanker-actueel.nl/NL/immuuntherapie-en-vaccins-een-overzicht.html
Op de website van het Anthonie van Leeuwenhoek ziekenhuis wordt deze studie zo aangekondigd:
Op 5 januari start het Antoni van Leeuwenhoek met een nieuw soort immuuntherapie (T-VEC), waarbij het herpes simplex virus (bekend als veroorzaker van de koortslip) wordt ingezet om melanoom te bestrijden. Daarmee is het arsenaal aan behandelingen tegen deze zeer agressieve vorm van huidkanker verder uitgebreid.
T-VEC is al door alle testfases heen en is goedgekeurd door Amerikaanse en Europese geneesmiddelenautoriteiten. Uniek aan het middel is dat voor de eerste keer een virus de basis van het medicijn vormt. Om precies te zijn, het herpes simplex virus, bekend als veroorzaker van de koortslip. Het virus is zo aangepast dat het deze aandoening niet meer kan veroorzaken. Maar het is wel in staat om kankercellen te doden. Als het lokaal in een melanoom wordt gespoten, gaat het virus zich in de kankercellen vermenigvuldigen. Zodra de cel tjokvol virussen zit, spat deze uiteen en verspreiden de virussen zich naar de omliggende cellen. In gezonde cellen kan het virus zich niet vermenigvuldigen. Het valt dus, heel selectief, alleen de kanker aan. Verder is er een eiwit bij het virus ingebouwd dat afweercellen aantrekt. Het idee hierachter is dat er lokaal een afweerreactie ontstaat waarbij het immuunsysteem de kankercellen ook gaat aanvallen.
Mildere behandeling
Chirurg dr. Alexander van Akkooi is, met zijn collega's van het Antoni van Leeuwenhoek, de eerste die vanaf begin januari het nieuwe middel, T-VEC, in Nederland zal toepassen. Van Akkooi: "Als chirurg probeer je kanker eerst zo veel mogelijk lokaal te behandelen. Maar het is niet altijd mogelijk om een melanoom chirurgisch te verwijderen. Met T-VEC hebben we nu een nieuwe optie in handen om de kanker lokaal aan te pakken, voordat we overgaan naar middelen die in het hele lichaam werken, zoals de targeted therapies en andere vormen van immuuntherapie." Zo'n lokale aanpak is milder. De kans op brede bijwerkingen is een stuk kleiner dan bij middelen die door het hele lichaam werken.
Combinatie
Het middel zal beschikbaar komen voor patiënten met lokale of regionale uitzaaiing van het melanoom in de huid, onderhuids of in lymfklieren (stadium IIIB, IIIC en IVA), maar zonder uitzaaiingen in organen. Lees verder>>>>>>>>>>>
Uw behandelend arts kan contact opnemen voor deelname aan een studie met immuuntherapie via dit telefoonnummer: We helpen u graag verder 020 512 9111
T-VEC demonstrates response in injected and uninjected lesions, and represents a new first-in-class oncolytic virus immunotherapy for patients with melanoma.
Patterns of Clinical Response with Talimogene Laherparepvec (T-VEC) in Patients with Melanoma Treated in the OPTiM Phase III Clinical Trial.
Abstract
PURPOSE:
Talimogene laherparepvec (T-VEC) is an oncolytic immunotherapy designed to induce tumor regression of injected lesions through direct lytic effects, and of uninjected lesions through induction of systemic antitumor immunity. In this study, we describe the patterns and time course of response to T-VEC from the phase III OPTiM trial of 436 patients with unresected stages IIIB-IV melanoma.
METHODS:
Lesion-level response analyses were performed based on the type of lesion (injected or uninjected cutaneous, subcutaneous, or nodal lesions; or visceral lesions ), and the best percentage change from baseline of the sum of products of the longest diameters was calculated. Patients randomized to T-VEC (n = 295) who experienced a durable response (continuous partial or complete response for ≥6 months) were evaluated for progression prior to response (PPR), defined as the appearance of a new lesion or >25 % increase in total baseline tumor area.
RESULTS:
T-VEC resulted in a decrease in size by ≥50 % in 64 % of injected lesions (N = 2116), 34 % of uninjected non-visceral lesions (N = 981), and 15 % of visceral lesions (N = 177). Complete resolution of lesions occurred in 47 % of injected lesions, 22 % of uninjected non-visceral lesions, and 9 % of visceral lesions. Of 48 patients with durable responses, 23 (48 %) experienced PPR, including 14 who developed new lesions only. No difference in overall survival was observed, and median duration of response was not reached in patients with PPR versus those without PPR.
CONCLUSIONS:
Responses in uninjected lesions provide validation of T-VEC-induced systemic immunotherapeutic effects against melanoma. PPR did not negatively impact the clinical effectiveness of T-VEC.
- PMID:
- 27342831
- PMCID:
- PMC5090012
- DOI:
- 10.1245/s10434-016-5286-0
- [PubMed - in process]
-
REFERENCES
1. Liu BL, Robinson M, Han ZQ, et al. ICP34.5 deleted herpes simplex virus with enhanced oncolytic, immune stimulating, and anti-tumour properties. Gene Therapy. 2003;10(4):292–303. doi: 10.1038/sj.gt.3301885. [PubMed] [Cross Ref]2. Senzer NN, Kaufman HL, Amatruda T, et al. Phase II clinical trial of a granulocyte-macrophage colony-stimulating factor-encoding, second-generation oncolytic herpesvirus in patients with unresectable metastatic melanoma. J Clin Oncol. 2009;27(34):5763–5771. doi: 10.1200/JCO.2009.24.3675. [PubMed] [Cross Ref]3. Andtbacka RHI, Kaufman HL, Collichio F, et al. Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. J Clin Oncol. 2015;33(25):2780–2788. doi: 10.1200/JCO.2014.58.3377. [PubMed] [Cross Ref]4. Hu JC, Coffin RS, Davis CJ, et al. A phase I study of OncoVEXGM-CSF, a second-generation oncolytic herpes simplex virus expressing granulocyte macrophage colony-stimulating factor. Clin Cancer Res. 2006;12(22):6737–6747. doi: 10.1158/1078-0432.CCR-06-0759. [PubMed] [Cross Ref]5. Hodi FS, Sznol M, Kluger HM, et al. Long-term survival of ipilimumab-naive patients (pts) with advanced melanoma (MEL) treated with nivolumab (anti-PD-1, BMS-936558, ONO-4538) in a phase I trial. ASCO Meeting Abstracts. 2014 2014;32(15 Suppl):9002.6. Topalian SL, Sznol M, McDermott DF, et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol. 2014;32(10):1020–1030. doi: 10.1200/JCO.2013.53.0105. [PMC free article] [PubMed] [Cross Ref]7. Wolchok JD, Hamid O, Ribas A, et al. Atypical patterns of response in patients (pts) with metastatic melanoma treated with pembrolizumab (MK-3475) in KEYNOTE-001. ASCO Meeting Abstracts. 2015;33(15 Suppl):3000.8. Miller AB, Hoogstraten B, Staquet M, Winkler A. Reporting results of cancer treatment. Cancer. 1981;47(1):207–214. doi: 10.1002/1097-0142(19810101)47:1<207::AID-CNCR2820470134>3.0.CO;2-6. [PubMed] [Cross Ref]9. Kaufman HL, Kim DW, DeRaffele G, Mitcham J, Coffin RS, Kim-Schulze S. Local and distant immunity induced by intralesional vaccination with an oncolytic herpes virus encoding GM-CSF in patients with stage IIIc and IV melanoma. Ann Surg Oncol. 2010;17(3):718–730. doi: 10.1245/s10434-009-0809-6. [PubMed] [Cross Ref]10. Wolchok JD, Hoos A, O’Day S, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res. 2009;15(23):7412–7420. doi: 10.1158/1078-0432.CCR-09-1624. [PubMed] [Cross Ref]11. Megahed A, Faulhaber P, Phillips T, Koon H. Delayed response in ipilimumab therapy. J Community Support Oncol. 2014;12(3):109–110. [PubMed]12. Chiou VL, Burotto M. Pseudoprogression and immune-related response in solid tumors. J Clin Oncol. 2015;33(31):3541–3543. doi: 10.1200/JCO.2015.61.6870. [PMC free article] [PubMed] [Cross Ref]13. Attia P, Phan GQ, Maker AV, et al. Autoimmunity correlates with tumor regression in patients with metastatic melanoma treated with anti-cytotoxic T-lymphocyte antigen-4. J Clin Oncol. 2005;23(25):6043–6053. doi: 10.1200/JCO.2005.06.205. [PMC free article] [PubMed] [Cross Ref]14. Gilardi L, Colandrea M, Vassallo S, Travaini LL, Paganelli G. Ipilimumab-induced immunomediated adverse events: possible pitfalls in (18)F-FDG PET/CT interpretation. Clin Nucl Med. 2014;39(5):472–474. doi: 10.1097/RLU.0b013e31828da691. [PubMed] [Cross Ref]15. Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) Eur J Cancer. 2009;45(2):228–247. doi: 10.1016/j.ejca.2008.10.026. [PubMed] [Cross Ref]16. Puzanov I, Milhem MM, Andtbacka RHI, et al. Primary analysis of a phase 1b multicenter trial to evaluate safety and efficacy of talimogene laherparepvec (T-VEC) and ipilimumab (ipi) in previously untreated, unresected stage IIIB-IV melanoma. ASCO Meeting Abstracts. 2014 2014;32(15 Suppl):9029.
Gerelateerde artikelen



Plaats een reactie ...
Reageer op "Immuuntherapie met gemoduleerd herpes virus succesvol bij melanoompatienten in Anthonie van Leeuwenhoek ziekenhuis."