16 december 2024: zie ook dit artikel: https://kanker-actueel.nl/car-t-therapie-met-ciltacabtagene-autoleucel-blijkt-ook-in-klinische-praktijk-uitstekende-behandeling-met-complete-remissie-van-74-procent-voor-patienten-met-recidief-of-gevorderde-multiple-myeloma-kahler-botkanker.html
15 december 2023: zie ook dit artikel als vervolg op onderstaand artikel: https://kanker-actueel.nl/ciltacabtagene-autoleucel-cilta-cel-infusie-geeft-lager-risico-op-ziekteprogressie-of-overlijden-en-meer-complete-remissies-dan-standaardzorg-bij-patienten-met-multiple-myeloma-met-lenalidomide-resistentie-die-1-tot-3-eerdere-therapieen-hadden-gekreg.html
17 december 2019: Zie ook dit artikel:
11 mei 2019:
Nieuwe vervolgstudie op onderstaande studie bewijst dat CAR-T cel therapie met bb2121 gericht op het B-cell maturation antigen (BCMA) een mogelijk goede behandeling kan zijn voor patienten met een recidief of progressie van zwaar voorbehandelde Multiple Myeloma, ziekte van Kahler:
Kernpunten uit deze fase I studie:
In deze fase I studie met 33 patiënten met recidief of progressie van Multiple Myeloma, werd bb2121 toegediend als een eenmalige infusie van CAR - T-cellen in de doses en veiligheidsstudie. Patiënten hadden ten minste drie eerdere behandelingen gehad, waaronder een proteasoomremmer en een immuunstimulerend medicijn, of waren ongevoelig voor beide geneesmiddelen.
Hematologische toxische effecten waren de meest voorkomende bijwerkingen van graad 3 of hoger. In totaal 25 patiënten (76%) hadden het zogeheten cytokine-afgifte syndroom.
Neurologische bijwerkingen traden op bij 14 patiënten (42%).
Het objectieve responspercentage was 85%; 15 patiënten (45%) hadden volledige respons, van wie er 6 recidief hebben gehad.
De mediane progressievrije overleving was 11,8 maanden. Alle patiënten met een respons (gedeeltelijke respons of beter) en die konden worden geëvalueerd voor minimale residuele ziekte (MRD) hadden een MRD-negatieve status.
De conclusie van de onderzoekers: Blijkbaar heeft bb2121 antitumoractiviteit in een vroege fase I klinische studie.
Absract van de studie, klik op de volgende link:
Anti-BCMA CAR T-Cell Therapy bb2121 in Relapsed or Refractory Multiple Myeloma
Maar lees ook artikel hieronder.
13 december 2017: Bron: ASH conferentie
CAR-T celtherapie is een vorm van immuuntherapie die bij vormen van melanomen, lymfklierkanker en leukemie uitstekende resultaten laten zien. Toch is er ook zorg bij deze vorm van immuuntherapie omdat bij een aantal patienten bij Car-T cel therapie het cytokine release syndrome (CRS) ontstaat dat vaak tot ernstige complicaties leidt en soms ook overlijden patiënten aan dat cytokine release syndrome (CRS)
Onderzoekers hebben nu een variant op CAR-T celtherapie (CAR-T cel anti BMCA therapy met het molecuul bb2121) ) in een studie onderzocht in een kleinschalige fase I studie met in eerste instantie 21 patiënten (die allemaal zwaar voorbehandeld waren en in laatste stadium van hun ziekte) waarvan er 18 overbleven voor een analyse. Op 6 maanden meting was de ziektevrije tijd: 81 procent, op 9 maanden 71 procent. 8 van de 9 patiënten met een complete remissie blijven al 9 maanden ziektevrij.
Heel bijzonder als je bedenkt dat de patienten deze volgende behandelingen hadden gehad.
Patients on study were heavily pre-treated, with a median of 7 prior therapies (range: 3 - 14):
- 100% previously treated with lenalidomide and bortezomib
- 91% previously treated with pomalidomide and carfilzomib
- 71% previously treated with daratumumab
- 29% of patients were penta-refractory (bortezomib, lenalidomide, carfilzomib, pomalidomide, daratumumab)
- All patients had at least one prior autologous stem cell transplant (ASCT)
Deze aangepaste Car-T cel therapie richt zich op een mutatie die veel voorkomt bij multiple myeloma (Kahler) en gebruikten daarvoor het B cell maturation antigen (BCMA) dat de CAR-T cellen moet leiden naar multiple myeloomcellen, samen met een co-stimulerend molecuul bb2121 en noemen dit een anti-BCMA CAR T-celtherapie. In grafiek werkingsmechanisme van deze CAR-T celtherapie. (tekst gaat verder onder grafiek
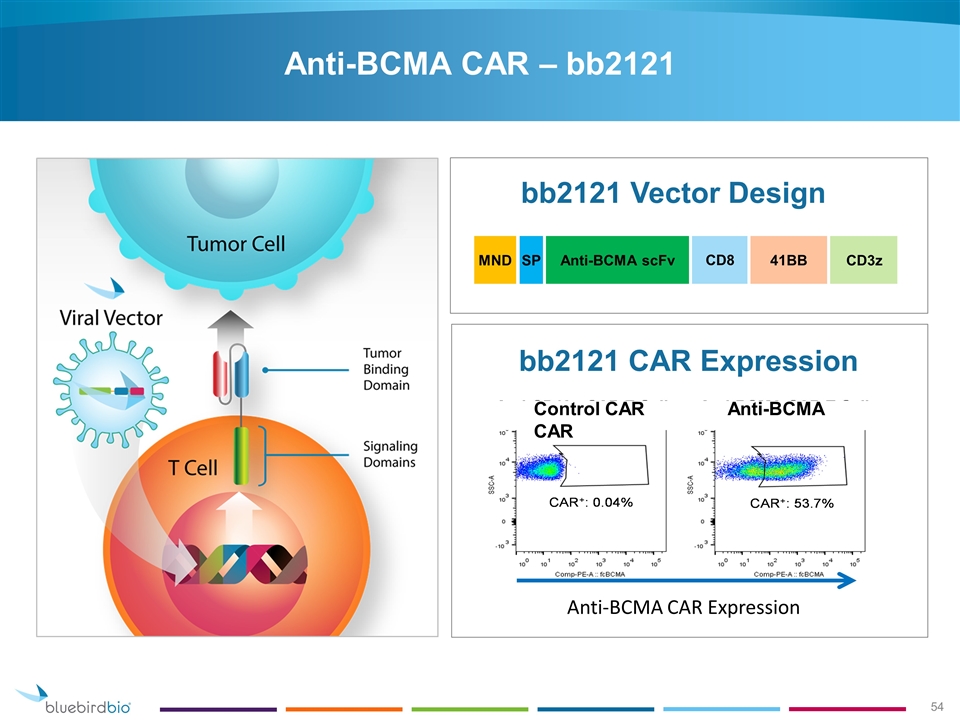
Uit een eerste analyse bleek het responspercentage 89%. Het responspercentage was wel dosisafhankelijk. Patiënten behandeld met een dosis van 15 x 107 hadden een 100% complete respons met hanteerbare bijwerkingen.
Vanaf 4 mei 2017 werden 21 patiënten (mediane leeftijd 58 jaar [range 37 tot 74] met gemiddeld 5 jaar (range 1 tot 16) levend met een multiple myeloma opgenomen in de studie. Zij kregen een infuus met het molecuul bb2121,
18 patienten bleven over voor een analyse na 1 maand voor een klinische respons. De patiënten hadden gemiddeld al eerder 7 andere behandelingen gehad (range 3 to 14), allemaal hadden eerder een autologe stamceltransplantatie gehad; 67% van de patiënten (15 patiënten) had een hoog risico op het ontstaan van een cytokine release syndrome - CRS omdat ze daar eerder aan waren blootgesteld en reacties daarop hadden laten zien en 6 van de 21 (29%) waren ongevoelig voor 5 eerdere chemokuren / behandelingen (Bort/Len/Car/Pom/Dara). 4 patiënten bereikten na 6 maanden een complete remissie.
Zo staat het in de update van de studieresultaten:
Results in the active dose cohorts (150 x 106, 450 x 106 and 800 x 106 CAR+ T cells; N=18) were:
- Median follow-up was 40 weeks (range: 6.6-69)
- 17/18 (94%) patients achieved an objective response
- 16/18 (89%) patients achieved at least a very good partial response (VGPR)
- 10/18 (56%) patients achieved a complete response (CR, N = 7), or unconfirmed complete response (N = 3)
- 9 of 10 patients who were evaluable for MRD status were found to be MRD-negative
- Median PFS has not been reached in the active dose cohorts. The PFS at 6 months and 9 months was 81% and 71%, respectively
- Three patients in the dose-escalation who responded to therapy subsequently experienced disease progression
De mediane follow-up na een infuus met bb2121 was 15,4 weken (range 1,4 tot 54,4 weken). Vanaf het moment waarop de gegevens werden geanalyseerd, waren er geen DLT's en geen behandelingsgerelateerde graad 3 of ernstigere neurotoxiciteiten waargenomen die vergelijkbaar waren met die welke eerder werden gemeld in andere CAR-T klinische studies.
Het cytokine release syndrome (CRS) werd gezien bij 71% van de patiënten maar voornamelijk in graad 1 en 2. Twee patiënten hadden CRS graad 3, dat binnen 24 uur was verdwenen. Het CRS kwam vaker voor in de groep met de hogere dosis, maar het leek niet gerelateerd te zijn aan de tumorbelasting.
"Deze studie toont aan dat deze nieuwe behandeling een goede verdraagbaarheid heeft. Deze nieuwe therapie kan belangrijke resultaten bereiken bij patiënten met multiple myeloma die geen andere behandelingsopties meer hebben. Deze nieuwe CAR-T celtherapie heeft een veelbelovende werkzaamheid met een hanteerbaar veiligheidsprofiel, " verklaarde Dr. Anderson op ASH "Dit kan een nieuwe behandelingsoptie wroden voor recidiverend of resistente multiple myeloma betekenen, de behandeling moet echter nog wel worden geoptimaliseerd en heeft meer onderzoek nodig."
Het studierapport: Durable Clinical Responses in Heavily Pretreated Patients with Relapsed/Refractory Multiple Myeloma: Updated Results from a Multicenter Study of bb2121 Anti-Bcma CAR T Cell Therapy werd gepresenteerd op ASH december 2017.
Hier het abstract:
CAR-Tel therapy with bb2121 shows promising efficacy at dose levels above 50 x 106 CAR+ T cells, with manageable CRS and no DLTs to date. ORR was 100% at these dose levels with 8 ongoing clinical responses at 6 months and 1 patient demonstrating a sustained response beyond one year. These initial data support the potential of CAR T therapy with bb2121 as a new treatment paradigm in refractory and resistent Multiple Myeloma (RRMM)
Durable Clinical Responses in Heavily Pretreated Patients with Relapsed/Refractory Multiple Myeloma: Updated Results from a Multicenter Study of bb2121 Anti-Bcma CAR T Cell Therapy
Type: Oral
Session: 653. Myeloma: Therapy, excluding Transplantation I
Methods: CRB-401 (NCT02658929) is a multi-center phase 1 dose escalation trial of bb2121 in patients with RRMM who have received ≥ 3 prior regimens, including a proteasome inhibitor and an immunomodulatory agent, or are double-refractory, and have ≥ 50% BCMA expression on malignant cells. Peripheral blood mononuclear cells are collected via leukapheresis and shipped to a central facility for transduction, expansion, and release testing prior to being returned to the site for infusion. Patients undergo lymphodepletion with fludarabine (30 mg/m2) and cyclophosphamide (300 mg/m2) daily for 3 days then receive 1 infusion of bb2121. The study follows a standard 3+3 design with planned dose levels of 50, 150, 450, 800, and 1,200 x 106 CAR+ T cells. The primary outcome measure is incidence of adverse events (AEs), including dose-limiting toxicities (DLTs). Additional outcome measures were quality and duration of clinical response assessed according to the IMWG Uniform Response Criteria for Multiple Myeloma, evaluation of minimal residual disease (MRD), overall and progression-free survival, quantification of bb2121 in blood, and quantification of circulating soluble BCMA over time.
Results: As of May 4, 2017, 21 patients (median 58 [37 to 74] years old) with a median of 5 (1 to 16) years since MM diagnosis, had been infused with bb2121, and 18 patients were evaluable for initial (1-month) clinical response. Patients had a median of 7 prior lines of therapy (range 3 to 14), all with prior autologous stem cell transplant; 67% had high-risk cytogenetics. Fifteen of 21 (71%) had prior exposure to, and 6 of 21 (29%) were refractory to 5 prior therapies (Bort/Len/Car/Pom/Dara). Median follow-up after bb2121 infusion was 15.4 weeks (range 1.4 to 54.4 weeks). As of data cut-off, no DLTs and no treatment-emergent Grade 3 or higher neurotoxicities similar to those reported in other CAR T clinical studies had been observed. Cytokine release syndrome (CRS), primarily Grade 1 or 2, was reported in 15 of 21 (71%) patients: 2 patients had Grade 3 CRS that resolved in 24 hours and 4 patients received tocilizumab, 1 with steroids, to manage CRS. CRS was more common in the higher dose groups but did not appear related to tumor burden. One death on study, due to cardiopulmonary arrest more than 4 months after bb2121 infusion in a patient with an extensive cardiac history, was observed while the patient was in sCR and was assessed as unrelated to bb2121. The overall response rate (ORR) was 89% and increased to 100% for patients treated with doses of 150 x 106 CAR+ T cells or higher. No patients treated with doses of 150 x 106 CAR+ T cells or higher had disease progression, with time since bb2121 between 8 and 54 weeks (Table 1). MRD negative results were obtained in all 4 patients evaluable for analysis. CAR+ T cell expansion has been demonstrated consistently and 3 of 5 patients evaluable for CAR+ cells at 6 months had detectable vector copies. A further 5 months of follow up on reported results and initial data from additional patients will be presented.
Conclusions: bb2121 shows promising efficacy at dose levels above 50 x 106 CAR+ T cells, with manageable CRS and no DLTs to date. ORR was 100% at these dose levels with 8 ongoing clinical responses at 6 months and 1 patient demonstrating a sustained response beyond one year. These initial data support the potential of CAR T therapy with bb2121 as a new treatment paradigm in RRMM.
CT.gov study NCT02658929, sponsored by bluebird bio and Celgene
Disclosures: Berdeja: Teva: Research Funding; Janssen: Research Funding; Novartis: Research Funding; Abbvie: Research Funding; Celgene: Research Funding; BMS: Research Funding; Takeda: Research Funding; Vivolux: Research Funding; Amgen: Research Funding; Constellation: Research Funding; Bluebird: Research Funding; Curis: Research Funding. Siegel: Celgene, Takeda, Amgen Inc, Novartis and BMS: Consultancy, Speakers Bureau; Merck: Consultancy. Jagannath: MMRF: Speakers Bureau; Bristol-Meyers Squibb: Consultancy; Merck: Consultancy; Celgene: Consultancy; Novartis: Consultancy; Medicom: Speakers Bureau. Turka: bluebird bio: Employment, Equity Ownership. Lam: bluebird bio: Employment, Equity Ownership. Hege: Celgene Corporation: Employment, Equity Ownership. Morgan: bluebird bio: Employment, Equity Ownership, Patents & Royalties. Quigley: bluebird bio: Employment, Equity Ownership, Patents & Royalties. Kochenderfer: Bluebird bio: Research Funding; N/A: Patents & Royalties: I have multiple patents in the CAR field.; Kite Pharma: Research Funding.
Gerelateerde artikelen
- CAR-T therapie met Ciltacabtagene autoleucel blijkt ook in klinische praktijk uitstekende behandeling met complete remissie van 74 procent voor patienten met recidief of gevorderde multiple Myeloma (Kahler - botkanker)
- Immuuntherapie met anti-BCMA/GPRC5D bispecifieke CAR T-cellen geeft als behandeling bij patiënten met recidief van Multiple Myeloma - Kahler uitstekende resultaten
- CAR T-celtherapie met het B-cell maturation antigen (BCMA) geeft alsnog complete remissies bij meer dan de helft van de 18 geselecteerde zwaar voorbehandelde patienten met vergevorderde multiple myeloma (Kahler)
- JNJ-4528 is een vorm van CAR-T cel behandeling en geeft uitstekende resultaten met 67 procent duurzame complete remissie in nieuwe studie bij uitbehandelde patienten met vergevorderde en zwaar voorbehandelde multiple myeloma
- CAR-T cel behandeling met Ciltacabtagene autoleucel (cilta-cel-infusie) geeft lager risico op ziekteprogressie of overlijden en meer complete remissies dan standaardzorg bij patiënten met multiple myeloma met lenalidomide resistentie



Plaats een reactie ...
Reageer op "CAR T-celtherapie met het B-cell maturation antigen (BCMA) geeft alsnog complete remissies bij meer dan de helft van de 18 geselecteerde zwaar voorbehandelde patienten met vergevorderde multiple myeloma (Kahler)"