Mocht u kanker-actueel de moeite waard vinden en ons willen ondersteunen om kanker-actueel online te houden dan kunt u ons machtigen voor een periodieke donatie via donaties of doneer al of niet anoniem op - rekeningnummer NL79 RABO 0372931138 t.n.v. Stichting Gezondheid Actueel in Amersfoort. Onze IBANcode is NL79 RABO 0372 9311 38
En we zijn een ANBI instelling dus uw donatie of gift is in principe aftrekbaar voor de belasting. En als donateur kunt u ook korting krijgen bij verschillende bedrijven:
https://kanker-actueel.nl/NL/voordelen-van-ops-lidmaatschap-op-een-rijtje-gezet-inclusief-hoe-het-kookboek-en-de-recepten-op-basis-van-uitgangspunten-van-houtsmullerdieet-te-downloaden-enof-in-te-zien.html
4 februari 2016: Lees ook: Minister Schippers heeft nivolumab voor gevorderde longkanker in het basispakket opgenomen per 1 maart 2016.
1 december 2015: Aanvullend op onderstaande informatie is het misschien wel goed om dit studierapport eens te lezen of mee te nemen en te bespreken met uw behandelend arts: Advances in immunotherapy for treatment of lung cancer
Het abstract van deze studie staat onderaan artikel met ook mooie referentielijst
23 september 2015: Bron: ASCO Post
Met immuuntherapie verandert de aanpak van longkanker, maar is er nog steeds een plek voor gerichte therapie?
Twee deskundigen van de Emory Universiteit bespraken deze kwestie op de Debates and Didactics in Hematology and Oncology Conference recent gehouden in Sea Island, Georgia. Fadlo Khuri, MD, is recent benoemd als President of the American University of Beirut in Lebanon, en Suresh S. Ramalingam, MD, is Professor and Director of Medical Oncology aan de Emory Universiteit.
Ik heb hun bespreking zoals die in ASCO Post is gepubliceerd met hulp van google translation vrij vertaald in het Nederlands en soms extra informatie aan toegevoegd.
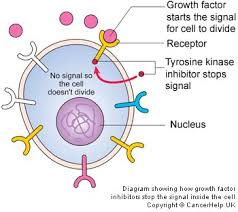
Foto: EGFR remmers
Doelgerichte behandeling op specifieke mutaties en receptoren expressie:
"In mijn ogen," zegt Dr. Khuri, "als een patiënt sterke DNA mutaties en een bepaalde receptoren expressie heeft dan is het logisch om in eerste instantie te kiezen voor een gerichte behandeling met EGFR remmers."
Longkanker vertoont ten minste drie opvallende mutaties (red: ALK, EGFR en BRAF), waarvan er tenminste bijna altijd één voorkomt bij minimaal 2/3 van de patiënten met adenocarcinomen. De helft of meer van deze patiënten zullen in eerste instantie dan ook goed reageren op gerichte medicijnen, met een duurzame controle van de ziekte," aldus Dr Khuri.
Deze gerichte behandelingen hebben een aantal voordelen: zo zijn de bekendste mutaties gemakkelijk vast te stellen, reageren patiënten meestal goed op de gerichte aanpak met doelgerichte medicijnen dus is er een grote mate van betrouwbaarheid en is er een gunstige kosten-batenverhouding en is er inmiddels veel kennis over de mechanismen van eventueel optredende resistentie.
De prognose van leven met niet-kleincellige longkanker (NSCLC) is dus drastisch veranderd met de ontdekking van mutaties in de epidermale groeifactor (EGFR). Het vermogen om dergelijke tumoren met tyrosine kinase remmers onder controle te houden met het behandelen van patiënten met een EGFR muitatie / expressie is inmiddels algemeen geaccepteerd en bekend. EGFR-remmers zijn en blijven inmiddels de eerstelijns standaard behandeling, zegt dr. Khuri.
Het ontstaan van resistentie is echter de achilleshiel van een doelgerichte behandeling met EGFR remmers. Maar er zijn inmiddels wel geneesmiddelen in ontwikkeling die de aanpak van dat probleem lijken op te lossen, vooral door het aanpakken van de specifieke T790M mutatie. Ongeveer bij de helft van de longkankerpatiënten bij wie de ziekte progressie vertoont treedt deze mutatie op.
"We hebben nu een indrukwekkend arsenaal aan gegevens waaruit blijkt dat we deze mutatie begrijpen. We begrijpen de biologie ervan en de prognose en we hebben inmiddels behandelingen / medicijnen die zich richten op juist deze T790M mutatie", zegt dr. Khuri.
Patiënten met een T790M mutatie zullen bijna altijd goed reageren op de derde generatie EGFR remmer met de naam AZD9291. In een onderzoek van 138 mutatie-positieve patiënten, bedroeg de ziektecontrole 95% (Zie referentie: 1. JANNE PA, Yang JC, Kim DW, et al: AZD9291 in EGFR remmer-resistent niet-kleincellige longkanker. N Engl J Med 372: 1689-1699, 2015.)
Soortgelijke middelen zijn in ontwikkeling, waaronder rociletinib (CO-1686), waarin ook een ziektebestrijding percentage van 93% werd aangetoond en produceerde positieve responses (aanslaan) bij bijna 60% van de patiënten met een T790M mutatie. (zie referentie 2. Sequist LV, Soria JC, Goldman JW, et al: Rociletinib in EGFR gemuteerde niet- kleincellige longkanker. N Engl J Med 372: 1700-1709, 2015.)
Het ALK fusie-gen vertegenwoordigt het andere "succesverhaal" van een doelgerichte behandeling. En de aanpak daarvan toont een opvallende effectiviteit (een verdubbeling van de progressievrije overleving) bij de 5% van de patiënten met niet-klein-cellige longkanker - NSCLC die deze ALK mutatie hebben. De ALK-remmer crizotinib (Xalkori) kreeg snel officiële toestemming van de FDA o.a.. (zie referentie 3. Shaw AT, Kim DW, Nakagawa K, et al: crizotinib versus chemotherapie in geavanceerde ALK-positieve longkanker. N Engl J Med 368: 2385-2394, 2013.)
Optredende resistentie tegen crizotinib wordt inmiddels ook onderzocht en men leert meer en meer over de mechanismen van resistentie tegen ALK remmers, die wel verschillen van die mechanismes die zijn waargenomen bij resistentie met EGFR-remmers. Derde generatie ALK inhibitoren zijn in ontwikkeling, waaronder ceritinib (Zykadia) en alectinib, welke effectief zijn bij meer dan 50% van eerder met crizotinib behandelde patiënten. De tweeledige ALK / EGFR-remmer AP26113 is ook actief bij patiënten met secundaire resistentie tegen ALK, merkt dr. Khuri op. (zie ook dit artikel: https://kanker-actueel.nl/NL/crizotinib-is-superieur-aan-pemetrexed-alimta-of-chemo-docetaxel-bij-niet-klein-cellige-longkanker-met-alk-positieve-genmutatie.html
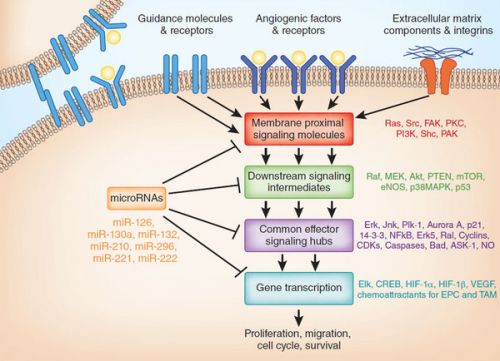
Foto: ALK werkingsmechanisme
BRAF, de derde bekende mutatie waarvoor een gerichte aanpak bestaat wordt bij longkankerpatiënten geïdentificeerd bij 1% tot 2% van de patiënten. Monotherapie met dabrafenib (Tafinlar) leverde een ziekte controle op van 56% na 12 weken en een mediane duur van de respons van 11,8 maanden bij eerder behandelde longkankerpatiënten. (zie referentie 4. Planchard D, Kim TM, Mazières J, et al: Dabrafenib in patients with BRAF V600E-mutant advanced non-small cell lung cancer: A multicenter, open-label phase II trial (BRF113928). 2014 ESMO Congress. Abstract LBA38_PR. Presented September 29, 2014.) (Zie ook: BRAF remmers bij longkanker: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4367599/)
De aanpak zou nog effectiever kunnen zijn in combinatie met trametinib (Mekinist), zegt Dr. Khuri.
De plaats van immuuntherapie:
Aangezien een doelgerichte therapie beperkt is tot patiënten met bekende mutaties en receptorenexpressie, is er ook een plaats voor immuuntherapie, vooral als tweede lijns behandeling, zegt Dr Khuri. "Als je weet dat je een bepaalde mutatie hebt, ga je aan de slag met een daarop gerichte therapie. Maar zonder een bekende mutatie, in de tweede lijns aanpak, ga je behandelen met nivolumab , welke superieur is aan chemo met docetaxel, "aldus dr. Khuri.
"Het geeft geen enkele discussie dat immuuntherapie het interessantste gebied binnen de oncologie is. Vooral als immuuntherapie wordt gecombineerd met korte chemokuren en/of bestraling. Met die combinatie zien we spectaculaire resultaten, ' erkent ook dr. Khuri.
Echter, Dr Khuri wees er ook op dat de voordelen ook kunnen worden vergezeld door meer bijwerkingen, meer toxiciteit (vooral met combinaties) dan wordt gezien met een gerichte behandeling. "Een van de meest evidente "toxiciteit" is te zien op de bankrekening!" Voegde hij eraan toe.
Voor een mediane progressievrije overleving van 6,9 maanden, kost nivolumab als monotherapie meer dan $ 100.000 per patiënt. Voor een mediane progressievrije overleving van 11,4 maanden, zijn de geschatte kosten $ 300.000, volgens sommige berekeningen.
"Naar mijn mening is dit waarschijnlijk meer dan de markt kan verdragen," is Dr Khuri's commentaar. "In combinatie met een 20% bijbetaling door patiënten zal dit onhoudbaar zijn."
Dr. Ramalingam wijst erop dat hoe goed een gerichte behandeling ook is, deze aanpak nog nooit een patiënt met longkanker heeft genezen. "Immuuntherapie heeft een veel sterkere invloed op longkanker dan welke gerichte behandeling dan ook, tot nu toe heeft gehad," zegt hij. "Immuuntherapie verbetert de overall overleving veel beter en kan zelfs genezend zijn en dit kan niet gezegd worden van de medicijnen die gebruikt worden in een gerichte behandeling." Aldus dr. Ramalingam
Bovendien voegde hij eraan toe, kan immuuntherapie worden toegepast op alle andere patiënten, dit in tegenstelling tot een gerichte behandeling. Het klinische effect is niet alleen voorbehouden aan personen die een weinig tot geen roken geschiedenis hebben (dat wil zeggen, niet de gemiddelde patiënt). Immuuntherapie richt zich op de "huis-, tuin- en keuken longkankerpatiënt," dat wil zeggen door roken ontstane tumoren met veel verschillende mutaties, aldus dr. Ramalingam.
Dr. Ramalingam herinnert de luisteraars eraan dat, "hoewel 65% van de longkankerpatiënten een afwijkende mutatie hebben, maar bij 25% van hen zal dat zijn in KRAS, welke mutatie nog steeds smeekt om een behandelingsoptie." Gerichte behandelingen worden daarom gebruikt bij een kleine percentage van onze longkankerpatiënten." Zegt dr. Ramalingam
Extra belemmeringen voor het gebruik van gerichte therapieën zijn het ontstaan van resistentie, waarvoor de huidige opties nog zijn beperkt, en hun falen om eerder in het ziekteverloop effectief te zijn. Echter, gerichte behandelingen hebben als voordeel over immuuntherapie dat ze vaker aanslaan - betere respons, erkent hij, maar voegt daaraan toe dat wanneer patiënten goed reageren op immuuntherapie, het effect duurzaam kan zijn.
Foto: cancer vaccines
Overleving met immuuntherapie:
"We hebben nu ook de algehele overleving gegevens die aantonen dat immuuntherapie met Nivolumab superieur blijkt te zijn," zei Dr Ramalingam.
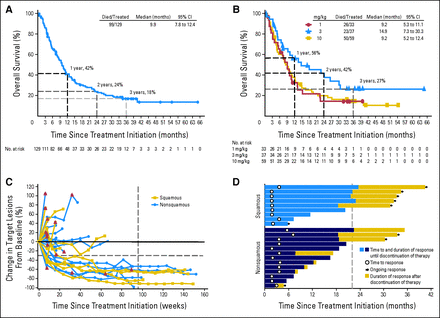
In een fase I studie van nivolumab in refractaire niet-kleincellige longkanker - NSCLC, de 2-jaars overleving was 24% en na 3 jaar blijkt 18% van zwaar voorbehandelde patiënten vrij van progressie te blijven, merkte hij op. "Om 3 jaar later nog in leven te zijn is een heel prettig vooruitzicht voor patienten waarvoor geen opties meer waren," voegt Dr. Ramalingam eraan toe.
In de fase III CheckMate 017 studie bij eerder behandelde longkankerpatiënten met een plaveiselcelcarcinoom, verbeterde nivolumab aanzienlijk beter de totale overleving dan docetaxel in de tweedelijns setting. (zie referentie: 6. Spigel DR, Reckamp KL, Rizvi NA, et al: A phase III study (CheckMate 017) of nivolumab vs docetaxel in previously treated advanced or metastatic squamous cell non-small cell lung cancer. 2015 ASCO Annual Meeting. Abstract 8009. Presented May 29, 2015.
"De hazard ratio van 0,59 steekt gunstig af bij de hazard ratio met gerichte behandelingen versus chemotherapie in de eerstelijns aanpak en dit is de tweede lijns,"voegde hij eraan toe. "First-line data zal vrijkomen binnen een jaar of zo, en als dit een teken is van wat komen gaat, dan gaan we een interessante tijd tegemoet."
De mogelijkheid van overleving op lange termijn wordt verder geïllustreerd door een studie onder leiding van Dr Ramalingam van nivolumab bij patiënten met plaveiselcelcarcinoom carcinoma die een recidief kregen. (Zie referentie 7. Rizvi NA, Mazières J, Planchard D, et al: Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): A phase 2, single-arm trial. Lancet Oncol 16:257-265, 2015.)
Hoewel de respons slechts 14% was, bereikten bijna alle patiënten waarbij de aanpak aansloeg een duurzame respons. als gevolg van nivolumab.
"Dat zegt ons veel over de kracht van immunotherapie", zegt hij. "Met gerichte therapie, de mediane progressievrije overleving is 10 tot 13 maanden. Bij deze patiënten, hebben we de mediane progressievrije tijd nog niet bereikt. "
Ook is er activiteit in niet plaveiselcarcinomen aangetoond en bewijst dat de anti-PD-1 (geprogrammeerde celdood) antilichamen geen "one-trick pony" zijn, vervolgde hij. Hoewel het een iets lagere hazard ratio opleverde (0,73), gaf nivolumab een betere overleving dan docetaxel als tweede lijns behandeling van patiënten met niet plaveiselcarcinomen in de fase III CheckMate 057 studie. (zie referentie 8. Paz-Ares, L, Horn L, Borghaei H, et al: Phase III, randomized trial (CheckMate 057) of nivolumab versus docetaxel in advanced non-squamous cell non-small cell lung cancer. 2015 ASCO Annual Meeting. Abstract LBA109. Presented May 29, 2015.)
"Deze twee studies tonen aan dat immuuntherapie met nivolumab gerichte therapie in de tweede lijns overklast," aldus dr. Ramalingam.
Zie ook hier een video van hoe nivolumab precies werkt: http://meetinglibrary.asco.org/content/111777?media=vm
Na Nivolumab:
Sterke resultaten zijn ook in aantocht voor anti-PD-1 / PD-L1 (de ligand) medicijnen anders dan nivolumab. In de fase II POPLAR studie, verbetert atezolizumab aanzienlijk de totale overleving versus docetaxel bij patiënten met een sterke PD-L1 expressie; De respons was 38%, en de mediane totale overleving was nog niet bereikt.( zie referentie 9. Spira AI, Park K, Mazières J, et al: Efficacy, safety and predictive biomarker results from a randomized phase II study comparing MPDL3280A vs docetaxel in 2L/3L NSCLC (POPLAR). 2015 ASCO Annual Meeting. Abstract 8010. Presented May 29, 2015.)
"Hoewel dergelijke bevindingen suggereren dat PD-L1 expressie kan helpen in de selectie van patiënten, zijn deze medicijen ook werkzaam bij patiënten zonder duidelijke PD-L1 expressie en blijken ook effectief bij PD-L1-negatieve patiënten. Hun resultaten zijn minstens zo goed als bij chemotherapie en we moeten dit in gedachten houden als we praten over een voorselectie van patiënten voor deze aanpak." Aldus Dr Ramalingam
Indrukwekkende resultaten werden ook bereikt bij PD-L1-positieve patiënten die pembrolizumab (Keytruda) kregen in de KEYNOTE-001.10 studie. In de recent bijgewerkte resultaten blijkt hoge expressie (≥ 50% vlekken) een een respons te geven van 52%, een mediane progressievrije overleving van 12,5 maanden en een mediane overleving die nog niet was bereikt.
De anti-PD-1 / PD-L1 middelen kunnen nog effectiever zijn in combinatie met andere medicijnen. In de vroege fase studies, heeft pembrolizumab plus chemotherapie een ziekte controle van 100%, met een relatief goede tolerantie, voegde hij eraan toe. (zie referentie 10. Garon EB, Rizvi NA, Hui R et al: Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 372:2018-2028, 2015.)
Tot slot, Dr. Ramalingam houdt vol in deze discussie dat immunotherapie de beste kans op de lange termijn biedt om te overleven met vergevorderde longkanker en een middel dat de biologie / ontwikkeling van deze ziekte kan veranderen.
Disclosure: Dr. Khuri heeft geen potentiële belangenconflicten gemeld. Dr. Ramalingam heeft gewerkt voor de adviesraden en heeft honoraria ontvangen van AstraZeneca, Bristol-Myers Squibb, Merck en Genentech.
References
1. Jänne PA, Yang JC, Kim DW, et al: AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer. N Engl J Med 372:1689-1699, 2015.
2. Sequist LV, Soria JC, Goldman JW, et al: Rociletinib in EGFR-mutated non-small cell lung cancer. N Engl J Med 372:1700-1709, 2015.
3. Shaw AT, Kim DW, Nakagawa K, et al: Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 368:2385-2394, 2013.
4. Planchard D, Kim TM, Mazières J, et al: Dabrafenib in patients with BRAF V600E-mutant advanced non-small cell lung cancer: A multicenter, open-label phase II trial (BRF113928). 2014 ESMO Congress. Abstract LBA38_PR. Presented September 29, 2014.
5. Brahmer J, Horn L, Antonia S: Nivolumab in patients with non-small cell lung cancer: Overall survival and long-term safety in phase 1 trial. 2013 IASLC 15th World Conference on Lung Cancer. Abstract MO 18.03.
6. Spigel DR, Reckamp KL, Rizvi NA, et al: A phase III study (CheckMate 017) of nivolumab vs docetaxel in previously treated advanced or metastatic squamous cell non-small cell lung cancer. 2015 ASCO Annual Meeting. Abstract 8009. Presented May 29, 2015.
7. Rizvi NA, Mazières J, Planchard D, et al: Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): A phase 2, single-arm trial. Lancet Oncol 16:257-265, 2015.
8. Paz-Ares, L, Horn L, Borghaei H, et al: Phase III, randomized trial (CheckMate 057) of nivolumab versus docetaxel in advanced non-squamous cell non-small cell lung cancer. 2015 ASCO Annual Meeting. Abstract LBA109. Presented May 29, 2015.
9. Spira AI, Park K, Mazières J, et al: Efficacy, safety and predictive biomarker results from a randomized phase II study comparing MPDL3280A vs docetaxel in 2L/3L NSCLC (POPLAR). 2015 ASCO Annual Meeting. Abstract 8010. Presented May 29, 2015.
10. Garon EB, Rizvi NA, Hui R et al: Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 372:2018-2028, 2015.
Bovenstaande is een vrije vertaling van het artikel uit de ASCO Post: Positioning Targeted and Immunotherapy-Based Approaches in Lung Cancer
Clinical trials with anti PD-1/PD-L1 antibodies in NSCLC have demonstrated very good tolerability and activity, with response rates around 20% and a median duration of response of 18 months.
Cancer Biol Med. 2015 Sep; 12(3): 209–222.
Advances in immunotherapy for treatment of lung cancer
Abstract
Different approaches for treating lung cancer have been developed over time, including chemotherapy, radiotherapy and targeted therapies against activating mutations. Lately, better understanding of the role of the immunological system in tumor control has opened multiple doors to implement different strategies to enhance immune response against cancer cells. It is known that tumor cells elude immune response by several mechanisms. The development of monoclonal antibodies against the checkpoint inhibitor programmed cell death protein 1 (PD-1) and its ligand (PD-L1), on T cells, has led to high activity in cancer patients with long lasting responses. Nivolumab, an anti PD-1 inhibitor, has been recently approved for the treatment of squamous cell lung cancer patients, given the survival advantage demonstrated in a phase III trial. Pembrolizumab, another anti PD-1 antibody, has received FDA breakthrough therapy designation for treatment of non-small cell lung cancer (NSCLC), supported by data from a phase I trial. Clinical trials with anti PD-1/PD-L1 antibodies in NSCLC have demonstrated very good tolerability and activity, with response rates around 20% and a median duration of response of 18 months.
References
1.
Finn OJ.. Cancer immunology. N Engl J Med 2008;358:2704-2715. [PubMed]2.
Roithmaier S, Haydon AM, Loi S, Esmore D, Griffiths A, Bergin P, et al. Incidence of malignancies in heart and/or lung transplant recipients: a single-institution experience. J Heart Lung Transplant 2007;26:845-849. [PubMed]3.
Anagnostou VK, Brahmer JR.. Cancer immunotherapy: a future paradigm shift in the treatment of non-small cell lung cancer. Clin Cancer Res 2015;21:976-984. [PubMed]4.
Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med 2002;8:793-800. [PubMed]5.
Velcheti V, Schalper KA, Carvajal DE, Anagnostou VK, Syrigos KN, Sznol M, et al. Programmed death ligand-1 expression in non-small cell lung cancer. Lab Invest 2014;94:107-116. [PubMed]6.
Butte MJ, Keir ME, Phamduy TB, Sharpe AH, Freeman GJ.. Programmed death-1 ligand 1 interacts specifically with the B7-1 costimulatory molecule to inhibit T cell responses. Immunity 2007;27:111-122. [PMC free article] [PubMed]7.
Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC, McDermott DF, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012;366:2443-2454. [PMC free article] [PubMed]8.
Brahmer JR, Drake CG, Wollner I, Powderly JD, Picus J, Sharfman WH, et al. Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates. J Clin Oncol 2010;28:3167-3175. [PubMed]9.
Lenschow DJ, Walunas TL, Bluestone JA.. CD28/B7 system of T cell costimulation. Annu Rev Immunol 1996;14:233-258. [PubMed]10.
Chen L, Ashe S, Brady WA, Hellstrom I, Hellstrom KE, Ledbetter JA, et al. Costimulation of antitumor immunity by the B7 counterreceptor for the T lymphocyte molecules CD28 and CTLA-4. Cell 1992;71:1093-1102. [PubMed]11.
Denkert C, Loibl S, Noske A, Roller M, Muller BM, Komor M, et al. Tumor-associated lymphocytes as an independent predictor of response to neoadjuvant chemotherapy in breast cancer. J Clin Oncol 2010;28:105-113. [PubMed]12.
Loi S, Sirtaine N, Piette F, Salgado R, Viale G, Van Eenoo F, et al. Prognostic and predictive value of tumor-infiltrating lymphocytes in a phase III randomized adjuvant breast cancer trial in node-positive breast cancer comparing the addition of docetaxel to doxorubicin with doxorubicin-based chemotherapy: BIG 02-98. J Clin Oncol 2013;31:860-867. [PubMed]13.
Fridman WH, Pages F, Sautes-Fridman C, Galon J.. The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer 2012;12:298-306. [PubMed]14.
Zhang L, Conejo-Garcia JR, Katsaros D, Gimotty PA, Massobrio M, Regnani G, et al. Intratumoral T cells, recurrence, and survival in epithelial ovarian cancer. N Engl J Med 2003;348:203-213. [PubMed]15.
Linsley PS, Brady W, Urnes M, Grosmaire LS, Damle NK, Ledbetter JA.. CTLA-4 is a second receptor for the B cell activation antigen B7. J Exp Med 1991;174:561-569. [PMC free article] [PubMed]16.
Thompson CB, Allison JP.. The emerging role of CTLA-4 as an immune attenuator. Immunity 1997;7:445-450. [PubMed]17.
Walunas TL, Lenschow DJ, Bakker CY, Linsley PS, Freeman GJ, Green JM, et al. CTLA-4 can function as a negative regulator of T cell activation. Immunity 1994;1:405-413. [PubMed]18.
Kearney ER, Walunas TL, Karr RW, Morton PA, Loh DY, Bluestone JA, et al. Antigen-dependent clonal expansion of a trace population of antigen-specific CD4+ T cells in vivo is dependent on CD28 costimulation and inhibited by CTLA-4. J Immunol 1995;155:1032-1036. [PubMed]19.
Krummel MF, Allison JP.. CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J Exp Med 1995;182:459-465. [PMC free article] [PubMed]20.
Krummel MF, Sullivan TJ, Allison JP.. Superantigen responses and co-stimulation: CD28 and CTLA-4 have opposing effects on T cell expansion in vitro and in vivo. Int Immunol 1996;8:519-523. [PubMed]21.
Tivol EA, Borriello F, Schweitzer AN, Lynch WP, Bluestone JA, Sharpe AH.. Loss of CTLA-4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4. Immunity 1995;3:541-547. [PubMed]22.
Huang CT, Workman CJ, Flies D, Pan X, Marson AL, Zhou G, et al. Role of LAG-3 in regulatory T cells. Immunity 2004;21:503-513. [PubMed]23.
Gandhi MK, Lambley E, Duraiswamy J, Dua U, Smith C, Elliott S, et al. Expression of LAG-3 by tumor-infiltrating lymphocytes is coincident with the suppression of latent membrane antigen-specific CD8+ T-cell function in Hodgkin lymphoma patients. Blood 2006;108:2280-2289. [PubMed]24.
Zhu C, Anderson AC, Schubart A, Xiong H, Imitola J, Khoury SJ, et al. The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity. Nat Immunol 2005;6:1245-1252. [PubMed]25.
Sabatos CA, Chakravarti S, Cha E, Schubart A, Sanchez-Fueyo A, Zheng XX, et al. Interaction of Tim-3 and Tim-3 ligand regulates T helper type 1 responses and induction of peripheral tolerance. Nat Immunol 2003;4:1102-1110. [PubMed]26.
Gao X, Zhu Y, Li G, Huang H, Zhang G, Wang F, et al. TIM-3 expression characterizes regulatory T cells in tumor tissues and is associated with lung cancer progression. PLoS One 2012;7:e30676. [PMC free article] [PubMed]27.
Zhuang X, Zhang X, Xia X, Zhang C, Liang X, Gao L, et al. Ectopic expression of TIM-3 in lung cancers: a potential independent prognostic factor for patients with NSCLC. Am J Clin Pathol 2012;137:978-985. [PubMed]28.
Zhou P, Shaffer DR, Alvarez Arias DA, Nakazaki Y, Pos W, Torres AJ, et al. In vivo discovery of immunotherapy targets in the tumour microenvironment. Nature 2014;506:52-57. [PMC free article] [PubMed]29.
Le Mercier I, Chen W, Lines JL, Day M, Li J, Sergent P, et al. VISTA regulates the development of protective antitumor immunity. Cancer Res 2014;74:1933-1944. [PMC free article] [PubMed]30.
Waterhouse P, Penninger JM, Timms E, Wakeham A, Shahinian A, Lee KP, et al. Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4. Science 1995;270:985-988. [PubMed]31.
Chambers CA, Sullivan TJ, Allison JP.. Lymphoproliferation in CTLA-4-deficient mice is mediated by costimulation-dependent activation of CD4+ T cells. Immunity 1997;7:885-895. [PubMed]32.
Sakuishi K, Apetoh L, Sullivan JM, Blazar BR, Kuchroo VK, Anderson AC.. Targeting Tim-3 and PD-1 pathways to reverse T cell exhaustion and restore anti-tumor immunity. J Exp Med 2010;207:2187-2194. [PMC free article] [PubMed]33.
Pardoll DM.. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 2012;12:252-264. [PubMed]34.
Karwacz K, Bricogne C, MacDonald D, Arce F, Bennett CL, Collins M, et al. PD-L1 co-stimulation contributes to ligand-induced T cell receptor down-modulation on CD8+ T cells. EMBO Mol Med 2011;3:581-592. [PMC free article] [PubMed]35.
Chen YB, Mu CY, Huang JA.. Clinical significance of programmed death-1 ligand-1 expression in patients with non-small cell lung cancer: a 5-year-follow-up study. Tumori 2012;98:751-755. [PubMed]36.
Chen YY, Wang LB, Zhu HL, Li XY, Zhu YP, Yin YL, et al. Relationship between programmed death-ligand 1 and clinicopathological characteristics in non-small cell lung cancer patients. Chin Med Sci J 2013;28:147-151. [PubMed]37.
Lee SY, Choi HK, Lee KJ, Jung JY, Hur GY, Jung KH, et al. The immune tolerance of cancer is mediated by IDO that is inhibited by COX-2 inhibitors through regulatory T cells. J Immunother 2009;32:22-28. [PubMed]38.
Srivastava MK, Andersson A, Zhu L, Harris-White M, Lee JM, Dubinett S, et al. Myeloid suppressor cells and immune modulation in lung cancer. Immunotherapy 2012;4:291-304. [PMC free article] [PubMed]39.
Lynch TJ, Bondarenko I, Luft A, Serwatowski P, Barlesi F, Chacko R, et al. Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small-cell lung cancer: results from a randomized, double-blind, multicenter phase II study. J Clin Oncol 2012;30:2046-2054. [PubMed]40.
Reck M, Bondarenko I, Luft A, Serwatowski P, Barlesi F, Chacko R, et al. Ipilimumab in combination with paclitaxel and carboplatin as first-line therapy in extensive-disease-small-cell lung cancer: results from a randomized, double-blind, multicenter phase 2 trial. Ann Oncol 2013;24:75-83. [PubMed]41. Zatloukal P, Heo SD, Park K, Kang J, Butts C, Bradford D, et al. Randomized phase II clinical trial comparing tremelimumab (CP-675,206) with best supportive care (BSC) following first-line platinum-based therapy in patients (pts) with advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2009;27:abstr 8071.
42.
Rizvi NA, Mazières J, Planchard D, Stinchcombe TE, Dy GK, Antonia SJ, et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial. Lancet Oncol 2015;16:257-265. [PubMed]43. Ramalingam SS, Mazières J, Planchard D, Stinchcombe TE, Dy GK, Antonia SJ, et al. Phase II study of nivolumab (anti-PD-1, BMS-936558, ONO-4538) in patients with advanced, refractory squamous non-small cell lung cancer: metastatic non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2014;90:1266-1267.
44. Rizvi NA, Shepherd FA, Antonia SJ, Bahmer JR, Chow LQ, Goldman J, et al. First-line monotherapy with nivolumab (Anti-PD-1; BMS-936558, ONO-4538) in advanced non-small cell lung cancer (NSCLC): safety, efficacy, and correlation of outcomes with PD-L1 status. Int J Radiat Oncol Biol Phys 2014;90:S31.
45. Brahmer JR, Horn L, Antonia SJ, Gandhi L, Sequist LV, Sankar V, et al. Survival and long-term follow-up of the phase I trial of nivolumab (Anti-PD-1; BMS-936558; ONO-4538) in patients (pts) with previously treated advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2013;31:abstr 8030.
46. Gettinger SN, Horn L, Gandhi L, Spigel DR, Antonia SJ, Rizvi NA, et al. Long-term survival, clinical activity, and safety of nivolumab (Anti-PD-1; BMS-936558, ONO-4538) in patients (Pts) with advanced non-small cell lung cancer (NSCLC). Int J Radiat Oncol Biol Phys 2014;90:S34.
47.
Brahmer J, Reckamp KL, Baas P, Crino L, Eberhardt WE, Poddubskaya E, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015;373:123-135. [PubMed]48. Paz-Ares L, Horn L, Borghaei H, Spigel DR, Steins M, Ready N, et al. Phase III, randomized trial (CheckMate 057) of nivolumab (NIVO) versus docetaxel (DOC) in advanced non-squamous cell (non-SQ) non-small cell lung cancer (NSCLC). J Clin Oncol 2015;33:LBA109.
49. Antonia SJ, Brahmer JR, Gettinger S, Chow LQ, Juergens R, Shepherd FA, et al. Nivolumab (Anti-PD-1; BMS-936558, ONO-4538) in combination with platinum-based doublet chemotherapy (PT-DC) in advanced non-small cell lung cancer (NSCLC). Int J Radiat Oncol Biol Phys 2014;90:S2.
50. Gettinger S, Chow LQ, Borghaei H, Shen Y, Harbison C, Chen AC, et al. Safety and response with nivolumab (Anti-PD-1; BMS-936558, ONO-4538) plus erlotinib in patients (Pts) with epidermal growth factor receptor mutant (EGFR MT) advanced non-small cell lung cancer (NSCLC). Int J Radiat Oncol Biol Phys 2014;90:S34-S35.
51. Rizvi NA, Chow LQ, Borghaei H, Shen Y, Harbison C, Alaparthy S, et al. Safety and response with nivolumab (anti-PD-1; BMS-936558, ONO-4538) plus erlotinib in patients (pts) with epidermal growth factor receptor mutant (EGFR MT) advanced NSCLC. J Clin Oncol 2014;32:abstr 8022.
52. Antonia SJ, Gettinger SN, Chow LQ, Juergens RA, Borghaei H, Shen Y, et al. Nivolumab (anti-PD-1; BMS-936558, ONO-4538) and ipilimumab in first-line NSCLC: Interim phase I results. J Clin Oncol 2014;32:abstr 8023.
53. Antonia SJ, Bendell JC, Taylor MH, Calvo E, Jaeger D, De Braud FG, et al. Phase I/II study of nivolumab with or without ipilimumab for treatment of recurrent small cell lung cancer (SCLC): CA209-032. J Clin Oncol 2015;33:abstr 7503.
54. Garon EB, Balmanoukian A, Hamid O, Hui R, Gandhi L, Leighi N, et al. Preliminary safety and clinical activity of MK-3475 in previously treated patients (pts) with non-small cell lung cancer (NSCLC). Annual Congress of the American Society of Clinical Oncology (ASCO) 2014.
55. Rizvi NA, Garon EB, Patnaik A, Gandhi L, Leighl NB, Balmanoukian AS, et al. Safety and clinical activity of MK-3475 as initial therapy in patients with advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2014;32:abstr 8007.
56. Ott PA, Maria Elez-Fernandez ME, Hiret S, Kim DW, Moss RA, Winser T, et al. Pembrolizumab (MK-3475) in patients (pts) with extensive-stage small cell lung cancer (SCLC): Preliminary safety and efficacy results from KEYNOTE-028. J Clin Oncol 2015;33:abstr 7502.
57. Patnaik A, Socinski MA, Gubens MA, Gandhi L, Stevenson J, Bachman RD, et al. Phase 1 study of pembrolizumab (pembro; MK-3475) plus ipilimumab (IPI) as second-line therapy for advanced non-small cell lung cancer (NSCLC): KEYNOTE-021 cohort D. J Clin Oncol 2015;33:abstr 8011.
58.
Brahmer JR, Tykodi SS, Chow LQ, Hwu WJ, Topalian SL, Hwu P, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med 2012;366:2455-2465. [PMC free article] [PubMed]59. Segal NH, Antonia SJ, Brahmer JR, Maio M, Blake-Haskins A, Li X, et al. Preliminary data from a multi-arm expansion study of MEDI4736, an anti-PD-L1 antibody. J Clin Oncol 2014;32:abstr 3002^.
60. Khleif S, Lutzky J, Segal N, Antonia S, Blake-Haskins A, Stewart R, et al. MEDI4736, an anti-PD-L1 antibody with modified Fc domain: Preclinical evaluation and early clinical results from a phase 1 study in patients with advanced solid tumors. Eur J Cancer 2013;49:abstr 802.
61. Soria JC, Cruz C, Bahleda R, Delord JP, Horn L, Herbst RS, et al. Clinical activity, safety, and biomarkers of a PD-L1 blockade in non-small cell lung cancer (NSCLC): additional analyses from a clinical study of the engineered antibody MPDL3280A (anti-PDL1). Eur J Cancer 2013;49:abstr 3408.
62. Spira AI, Park K, Mazières J, Vansteenkiste JF, Rittmeyer A, Ballinger M, et al. Efficacy, safety and predictive biomarker results from a randomized phase II study comparing atezolizumab vs docetaxel in 2L/3L NSCLC (POPLAR). J Clin Oncol 2015;33:abstr 8010.
63.
Gettinger SN, Horn L, Gandhi L, Spigel DR, Antonia SJ, Rizvi NA, et al. Overall survival and long-term safety of nivolumab (Anti-programmed death 1 antibody, BMS-936558, ONO-4538) in patients with previously treated advanced non-small-cell lung cancer. J Clin Oncol 2015;33:2004-2012. [PubMed]64. Garon EB, Gandhi L, Rizvi N, Hui R, Balmanoukian AS, Patnaik A, et al. Antitumor activity of pembrolizumab (pembro; MK-3475) and correlation with programmed death ligand 1 (PD-l1) expression in a pooled analysis of patients (pts) with advanced non–small cell lung carcinoma (NSCLC). Ann Oncol 2014;25:v1-v41.
65. Lutzky J, Antonia SJ, Blake-Haskins A, Li X, Robbins PB, Shalabi AM, et al. A phase 1 study of MEDI4736, an anti–PD-L1 antibody, in patients with advanced solid tumors. J Clin Oncol 2014;32:abstr 3001^.
66. Spigel DR, Gettinger SN, Horn L, Herbst RS, Gandhi L, Gordon MS, et al. Clinical activity, safety, and biomarkers of MPDL3280A, an engineered PD-L1 antibody in patients with locally advanced or metastatic non-small cell lung cancer (NSCLC). J Clin Oncol 2013;31:abstr 8008.
67.
Herbst RS, Soria JC, Kowanetz M, Fine GD, Hamid O, Gordon MS, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature 2014;515:563-567. [PubMed]68. Gandhi L, Balmanoukian A, Hui R, Hamid O, Rizvi NA, Leighl N, et al. Abstract CT105: MK-3475 (anti-PD-1 monoclonal antibody) for non-small cell lung cancer (NSCLC): Antitumor activity and association with tumor PD-L1 expression. Cancer Res 2014;74:CT105.
69. Gettinger SN, Shepherd FA, Antonia SJ, Brahmer JR, Quan Man Chow L, Juergens RA, et al. First-line nivolumab (anti-PD-1; BMS-936558, ONO-4538) monotherapy in advanced NSCLC: Safety, efficacy, and correlation of outcomes with PD-L1 status. J Clin Oncol 2014;32:abstr 8024.
70. Brahmer JR, Horn L, Gandhi L, Spigel DR, Antonia SJ, Rizvi NA, et al. Nivolumab (anti-PD-1, BMS-936558, ONO-4538) in patients (pts) with advanced non-small-cell lung cancer (NSCLC): Survival and clinical activity by subgroup analysis. J Clin Oncol 2014;32:abstr 8112^.
71. Brahmer JR, Rizvi NA, Lutzky J, Khleif S, Blake-Haskins A, Li X, et al. Clinical activity and biomarkers of MEDI4736, an anti-PD-L1 antibody, in patients with NSCLC. J Clin Oncol 2014;32:abstr 8021^.
72.
Garon EB, Rizvi NA, Hui R, Leighl N, Balmanoukian AS, Eder JP, et al. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 2015;372:2018-2028. [PubMed]73.
Taube JM, Klein A, Brahmer JR, Xu H, Pan X, Kim JH, et al. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy. Clin Cancer Res 2014;20:5064-5074. [PMC free article] [PubMed]74.
Tumeh PC, Harview CL, Yearley JH, Shintaku IP, Taylor EJ, Robert L, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature 2014;515:568-571. [PMC free article] [PubMed]75.
Chen Z, Fillmore CM, Hammerman PS, Kim CF, Wong KK.. Non-small-cell lung cancers: a heterogeneous set of diseases. Nat Rev Cancer 2014;14:535-546. [PubMed]76.
Frederick DT, Piris A, Cogdill AP, Cooper ZA, Lezcano C, Ferrone CR, et al. BRAF inhibition is associated with enhanced melanoma antigen expression and a more favorable tumor microenvironment in patients with metastatic melanoma. Clin Cancer Res 2013;19:1225-1231. [PMC free article] [PubMed]77.
Akbay EA, Koyama S, Carretero J, Altabef A, Tchaicha JH, Christensen CL, et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors. Cancer Discov 2013;3:1355-1363. [PMC free article] [PubMed]78. D’Incecco A, Andreozzi M, Ludovini V, Rossi E, Landi L, Minuti G, et al. PD-L1 and PD-1 expression in molecularly selected non-small-cell lung cancer (NSCLC) patients. J Thorac Oncol 2014;9:S7-S52.
79.
Robert C, Thomas L, Bondarenko I, O’Day S, Weber J, Garbe C, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011;364:2517-2526. [PubMed]80.
Postow MA, Callahan MK, Barker CA, Yamada Y, Yuan J, Kitano S, et al. Immunologic correlates of the abscopal effect in a patient with melanoma. N Engl J Med 2012;366:925-931. [PMC free article] [PubMed]81.
Kong YC, Flynn JC.. Opportunistic autoimmune disorders potentiated by immune-checkpoint inhibitors anti-CTLA-4 and Anti-PD-1. Front Immunol 2014;5:206. [PMC free article] [PubMed]82.
Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CL, Lao CD, et al. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 2015;373:23-34. [PubMed]83.
McDermott D, Haanen J, Chen TT, Lorigan P, O’Day S.. Efficacy and safety of ipilimumab in metastatic melanoma patients surviving more than 2 years following treatment in a phase III trial (MDX010-20). Ann Oncol 2013;24:2694-2698. [PubMed]84.
Danielli R, Ridolfi R, Chiarion-Sileni V, Queirolo P, Testori A, Plummer R, et al. Ipilimumab in pretreated patients with metastatic uveal melanoma: safety and clinical efficacy. Cancer Immunol Immunother 2012;61:41-48. [PubMed]85.
Yousaf N, Davidson M, Goode E, Thomas C, Hung R, Gore M, et al. The cost of ipilimumab toxicity: a single-centre analysis. Melanoma Res 2015;25:259-264. [PubMed]86.
McDermott DF, Drake CG, Sznol M, Choueiri TK, Powderly JD, Smith DC, et al. Survival, durable response, and long-term safety in patients with previously treated advanced renal cell carcinoma receiving nivolumab. J Clin Oncol 2015;33:2013-2020. [PMC free article] [PubMed]87.
Woo SR, Turnis ME, Goldberg MV, Bankoti J, Selby M, Nirschl CJ, et al. Immune inhibitory molecules LAG-3 and PD-1 synergistically regulate T-cell function to promote tumoral immune escape. Cancer Res 2012;72:917-927. [PMC free article] [PubMed]88.
Benson DM, Jr, Cohen AD, Jagannath S, Munshi NC, Spitzer G, Hofmeister CC, et al. A phase I trial of the anti-KIR antibody IPH2101 and lenalidomide in patients with relapsed/refractory multiple myeloma. Clin Cancer Res 2015;21:4055-4061. [PMC free article] [PubMed]89.
Clouthier DL, Zhou AC, Watts TH.. Anti-GITR agonist therapy intrinsically enhances CD8 T cell responses to chronic lymphocytic choriomeningitis virus (LCMV), thereby circumventing LCMV-induced downregulation of costimulatory GITR ligand on APC. J Immunol 2014;193:5033-5043. [PubMed]90.
Kobayashi T, Doff BL, Rearden RC, Leggatt GR, Mattarollo SR.. NKT cell-targeted vaccination plus anti-4-1BB antibody generates persistent CD8 T cell immunity against B cell lymphoma. Oncoimmunology 2015;4:e990793. [PMC free article] [PubMed]91.
Lei F, Song J, Haque R, Haque M, Xiong X, Fang D, et al. Regulation of A1 by OX40 contributes to CD8(+) T cell survival and anti-tumor activity. PLoS One 2013;8:e70635. [PMC free article] [PubMed]92.
Batchu RB, Gruzdyn O, Potti RB, Weaver DW, Gruber SA.. MAGE-A3 with cell-penetrating domain as an efficient therapeutic cancer vaccine. JAMA Surg 2014;149:451-457. [PubMed]93.
Ohgami A, Tsuda T, Osaki T, Mitsudomi T, Morimoto Y, Higashi T, et al. MUC1 mucin mRNA expression in stage I lung adenocarcinoma and its association with early recurrence. Ann Thorac Surg 1999;67:810-814. [PubMed]94.
Mitchell P, Thatcher N, Socinski MA, Wasilewska-Tesluk E, Horwood K, Szczesna A, et al. Tecemotide in unresectable stage III non-small-cell lung cancer in the phase III START study: updated overall survival and biomarker analyses. Ann Oncol 2015;26:1134-1142. [PubMed]95.
Rodriguez PC, Neninger E, Garcia B, Popa X, Viada C, Luaces P, et al. Safety, immunogenicity and preliminary efficacy of multiple-site vaccination with an epidermal growth factor (EGF) based cancer vaccine in advanced non small cell lung cancer (NSCLC) patients. J Immune Based Ther Vaccines 2011;9:7. [PMC free article] [PubMed]96.
Brunsvig PF, Kyte JA, Kersten C, Sundstrom S, Moller M, Nyakas M, et al. Telomerase peptide vaccination in NSCLC: a phase II trial in stage III patients vaccinated after chemoradiotherapy and an 8-year update on a phase I/II trial. Clin Cancer Res 2011;17:6847-6857. [PubMed]97.
Kakimi K, Isobe M, Uenaka A, Wada H, Sato E, Doki Y, et al. A phase I study of vaccination with NY-ESO-1f peptide mixed with Picibanil OK-432 and Montanide ISA-51 in patients with cancers expressing the NY-ESO-1 antigen. Int J Cancer 2011;129:2836-2846. [PubMed]98. Giaccone G, Bazhenova L, Nemunaitis J, et al. A phase III study of belagenpumatucel-L therapeutic tumor cell vaccine for non-small cell lung cancer. 2013 Europen Cancer Congress 2013:Abs LBA2.
99. Morris JC, Rossi GR, Harold N, Tennant L, Ramsey WJ, Vahanian N, et al. Potential chemo-sensitization effect of tergenpumatucel-L immunotherapy in treated ptients with advanced non-small cell lung cancer 8NSCLC). J Clin Oncol 2013;31:abstr 8094.
100.
Iversen TZ, Engell-Noerregaard L, Ellebaek E, Andersen R, Larsen SK, Bjoern J, et al. Long-lasting disease stabilization in the absence of toxicity in metastatic lung cancer patients vaccinated with an epitope derived from indoleamine 2,3 dioxygenase. Clin Cancer Res 2014;20:221-232. [PubMed]
nivolumab, longkanker, niet-kleincellige longkanker, anti-PD medicijn, personalised medicine, immuuntherapie, Pembrolizumab, atezolizumab, Ligand-1, DNA mutatie, receptorstatus
Gerelateerde artikelen









Plaats een reactie ...
Reageer op "Longkanker: Immuuntherapie en gerichte therapie bij longkanker zijn de beste opties, maar wat zijn de verschillen en wanneer deze in te zetten? copy 1"