Aan dit artikel is vele uren gewerkt. Opzoeken, vertalen, op de website plaatsen enz. Als u ons wilt ondersteunen dan kan dat via een al of niet anonieme donatie. Elk bedrag is welkom hoe klein ook. Klik hier als u ons wilt helpen kanker-actueel online te houden. Wij zijn een ANBI organisatie en dus is uw donatie in principe aftrekbaar voor de belasting.
2 mei 2024: zie ook dit artikel: https://kanker-actueel.nl/microbioom-darmflora-van-de-dunne-darm-duodenale-blijkt-significant-veranderd-bij-personen-met-overgewicht-en-obesitas-vergeleken-met-die-bij-mensen-met-een-normaal-gewicht.html
10 mei 2015: Bron: Nature Communications
Verandering van dieet verandert in twee weken de kans op darmkanker door effecten op darmflora en ontlastingssamenstelling.
Een dieet van plantaardige eiwitten, goede vetten en met veel goed oplosbare vezels, veranderde in twee weken tijd de darmflora en ontlastingssamenstelling bij Zuid-Afrikaanse mannen die een voornamelijk westers dieet gebruiken zodanig dat de onderzoekers beweren dat hiermee bewezen wordt dat zij daardoor minder risico op ontwikkelen van darmkanker hebben.

Grafiek: Verandering van darmflora na twee weken verandering van dieet
Het lijkt een te simpel bericht: een studie van slechts twee weken bij slechts 40 Afrikaanse mannen totaal (20 om 20). Maar wie kijkt naar de opzet van de studie ziet dat dit een hele degelijke studie is uitgevoerd door onderzoekers aan de University of Pittsburgh School of Medicine en gepubliceerd in Nature Communications. Een bewijs ook dat wetenschappelijk onderzoek naar effecten van voeding en levenstijl niet duur en complex hoeft te zijn.
Opzet van de studie:
Stephen O’Keefe, MD, Professor of Medicine, Division of Gastroenterology, Hepatology, and Nutrition aan de University of Pittsburgh School of Medicine had in zijn praktijk in Zuid-afrika opgemerkt dat oorspronkelijke Afrikanen zelden darmkanker hadden of darmpoliepen, vaak een voorbode van darmkanker. In de westerse wereld is darmkanker een van de meest voorkomende vormen van kanker en het aantal sterfgevallen door darmkanker is tweede op de lijst van overlijden aan kanker in Amerika. Onder Afrikaans-Amerikaanse mannen in Amerika is het aantal sterfgevallen door kanker heel hoog.
“Het Afrikaans-Amerikaanse dieet, dat veel dierlijke eiwitten en vetten bevat en minder oplosbare vezels dan het Afrikaanse dieet lijkt de oorzaak te zijn van het risico op darmkanker.”“Andere studies met bv. Japanse immigranten naar Hawaii hebben aangetoond dat slechts 1 generatie nodig is om het lage risico op darmkanker dat oorsponkelijke bewoners van Hawaii hebben te veranderen naar een hoog riscio zoals alle westerse mensen hebben", aldus Dr. O’Keefe.
In deze studie onderzochten Dr. O’Keefe en zijn collega's wat de gevolgen zouden zijn van een korte maar gecontroleerde verandering van dieet op de darmflora en ontlastingssamenstelling van Afrikaanse en Afrikaans-Amerikaanse mannen. Zonder invloeden van roken of andere omgevingsfactoren en met een 100% controle op de dieetsamenstelling.
Samenstelling van het dieet:
Voor de studie vroegen de onderzoekers 40 Afrikaanse mannen in de leeftijd van 50 tot 65 jaar als vrijwilligers voor deze studie. De mannen werden gezocht op hun dieet dat zij gebruikten en ingedeeld in twee groepen van 20 mannen. Groep A was een groep van 20 Afrikaans-Amerikaanse mannen die in het dagelijks leven een westers dieet gebruikten. Groep B was een groep van 20 Afrikaanse mannen die het oorspronkelijke Afrikaanse dieet gebruikten.
Grafiek: Darmflora van een Afrikaanse man uit de studie
Groep A werd twee weken gehuisvest in een ruimte aan de universiteit van Pittsburg. de andere groep B op een Afrikaanse locatie. Voor de mannen in groep A bereidden de onderzoekers dagelijks, twee weken lang, een dieet met bijbehorende kooktechnieken op basis van het oorspronkeljke Afrikaanse dieet. Met veel plantaardige eiwitten, weinig dierlijke vetten en veel oplosbare vezels. Voor groep B werd twee weken lang een westers dieet gemaakt, ook met bijbehorende kooktechnieken.
Studie resultaten:
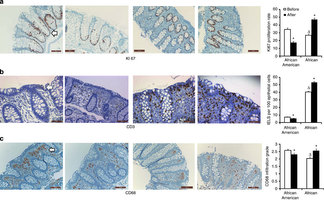
Hoewel de dieetverandering kort was, dus slechts twee weken, bij alle mannen veranderde de darmflora, de waarden van vezel fermentatie en de markers van bacteriële metabolische activiteit en ontstekingen die samenhangen met het riscio op darmkanker. In het bijzonder ervaarden Afrikaans-Amerikaanse mannen een stijging van butyrate productie - korte keten vetzuren, waarvan wordt aangenomen dat deze een cruciale rol spelen in het ontstaan van kanker en kanker 'pathways'. De onderzoekers merkten ook op dat zij bij 9 Afrikaans-Amerikaanse mannen darmpoliepen hebben verwijderd. Bij de oorsponkelijke Afrikaanse mannen geen enkele. Geen van deze mannen had poliepen. Bj de Afrikaans-Amerikaanse mannen dus had bijna de helft 9 uit 20 darmpoliepen.
‘Het is nooit te laat om het risico op kanker te verminderen', aldus dr. O’Keefe'
“We kunnen op basis van deze studie natuurlijk niet definitef concluderen dat de metingen in deze studie ook daadwerkelijk tot meer gevallen van kanker zouden hebben geleid in de Afrikaanse groep mannen, net zo min tot minder gevallen van kanker in de groep van Afrikaans-Amerikaanse mannen, maar er is goed bewijs in andere eerder uitgevoerde studies dat de door ons gevonden resultaten leiden tot een verandering van het risico op darmkanker, "zegt co-auteur Jeremy Nicholson, PhD, van het Imperial College London.
Volgens Dr. O’Keefe, kan een stijging van de hoeveelheid goed oplosbare vezels in een dieetverandering - van circa 10 gram tot meer dan 50 gram voor Afrikaans-Amerikaanse mannen - leiden tot biomoleculaire veranderingen die gerelateerd zijn aan minder risico op kanker, maar het minder eten van dierlijke eiwitten en vetten kan ook hulpzaam zijn.
“Deze resultaten zijn echt goed nieuws ” aldus Jeremy Nicholson, PhD. “In slechts twee weken een verandering van een westers dieet in een oorspronkeljik Afrikaans dieet met veel vezels en weinig slechte vetten veranderde de biomarkers voor het risico op kanker, daarmee lijkt een verandering van dieet nooit te laat om het riscio op kanker te verminderen".
Dr. O’Keefe is de auteur van het artikel in Nature Communications. Ook het NWO - Nederlandse Organisatie voor Wetenschappelijk Onderzoek heeft aan deze studie meegedaan, maar nog niet gepubliceerd op hun website. Terwijl ASCO Post deze studie al meldt. Maar goed komnt misschien nog
This study was supported by the National Institutes of Health, the National Institute for Health Research Imperial Biomedical Research Centre, UK, the Academy of Medical Sciences, the Netherlands Organization for Scientific Research, the European Research Council, and the Academy of Finland.
Het volledige studieverslag: Fat, fibre and cancer risk in African Americans and rural Africans is tegen betaling in te zien.
Het origenele artikel: Two-Week International Diet Swap Shows Potential Effects of Food on Colon Cancer Risk uit ASCO Post heeft als voorbeeld gediend voor bovenstaande vrij vertaalde artikel
Hier het abstract van de studie:
Two-Week International Diet Swap Shows Potential Effects of Food on Colon Cancer Risk
Fat, fibre and cancer risk in African Americans and rural Africans
- Nature Communications
- 6,
- Article number:
- 6342
- doi:10.1038/ncomms7342
- Received
- Accepted
- Published
-
Abstract
Rates of colon cancer are much higher in African Americans (65:100,000) than in rural South Africans (<5:100,000). The higher rates are associated with higher animal protein and fat, and lower fibre consumption, higher colonic secondary bile acids, lower colonic short-chain fatty acid quantities and higher mucosal proliferative biomarkers of cancer risk in otherwise healthy middle-aged volunteers. Here we investigate further the role of fat and fibre in this association. We performed 2-week food exchanges in subjects from the same populations, where African Americans were fed a high-fibre, low-fat African-style diet and rural Africans a high-fat, low-fibre western-style diet, under close supervision. In comparison with their usual diets, the food changes resulted in remarkable reciprocal changes in mucosal biomarkers of cancer risk and in aspects of the microbiota and metabolome known to affect cancer risk, best illustrated by increased saccharolytic fermentation and butyrogenesis, and suppressed secondary bile acid synthesis in the African Americans.
- et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int. J. Cancer 127, 2893–2917 (2010).
- Cancer among Japanese migrants to Hawaii: gene-environment interactions. Rev. Epidemiol. Sant. Publiq. 40, 425–430 (1992).
- , , & Fruits and vegetables: updating the epidemiologic evidence for the WCRF/AICR lifestyle recommendations for cancer prevention. Cancer Treat. Res. 159, 35–50 (2014).
- et al. Why do African Americans get more colon cancer than Native Africans? J. Nutr. 137, (1 Suppl): 175S–182S (2007).
- et al. Diet, microbiota, and microbial metabolites in colon cancer risk in rural Africans and African Americans. Am. J. Clin. Nutr. 98, 111–120 (2013).
- et al. Pattern of epithelial cell proliferation in colorectal mucosa of normal subjects and of patients with adenomatous polyps or cancer of the large bowel. Cancer Res. 48, 4121–4126 (1988).
- & Microbial induction of immunity, inflammation, and cancer. Front. Physiol. 1, 168 (2011).
- & The microbiota and its metabolites in colonic mucosal health and cancer risk. Nutr. Clin. Prac. 27, 624–635 (2012).
- et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science 341, 569–573 (2013).
- et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch. Toxicol. 85, 863–871 (2011).
- et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 505, 559–563 (2014).
- et al. Linking long-term dietary patterns with gut microbial enterotypes. Science 334, 105–108 (2011).
- , , & Diversity of human colonic butyrate-producing bacteria revealed by analysis of the butyryl-CoA:acetate CoA-transferase gene. Environ. Microbiol. 12, 304–314 (2010).
- , & Sulphate reducing bacteria and hydrogen metabolism in the human large intestine. Gut 34, 437–439 (1993).
- et al. Phylogenetic relationships of butyrate-producing bacteria from the human gut. Appl. Environ. Microbiol. 66, 1654–1661 (2000).
- et al. Development and application of the human intestinal tract chip, a phylogenetic microarray: analysis of universally conserved phylotypes in the abundant microbiota of young and elderly adults. Environ. Microbiol. 11, 1736–1751 (2009).
- Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature 486, 207–214 (2012).
- & Systems biology: metabonomics. Nature 455, 1054–1056 (2008).
- , , & MetaboNetworks, an interactive Matlab-based toolbox for creating, customizing and exploring sub-networks from KEGG. Bioinformatics 30, 893–895 (2014).
- & Microbial conversion of choline to trimethylamine requires a glycyl radical enzyme. Proc. Natl Acad. Sci. USA 109, 21307–21312 (2012).
- et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature 472, 57–63 (2011).
- Dietary bioactive compounds and their health implications. J. Food Sci. 78, (Suppl 1): A18–A25 (2013).
- & Identification and characterization of a bile acid 7α-dehydroxylation operon in Clostridium sp. strain TO-931, a highly active 7α-dehydroxylating strain isolated from human feces. Appl. Environ. Microbiol. 66, 1107–1113 (2000).
- et al. Bile acid concentrations, cytotoxicity, and pH of fecal water from patients with colorectal adenomas. Digest. Dis. Sci. 44, 2218–2225 (1999).
- , , , & Bile acids as carcinogens in human gastrointestinal cancers. Mutat. Res. 589, 47–65 (2005).
- et al. Inhibition by resistant starch of red meat-induced promutagenic adducts in mouse colon. Cancer Prev. Res. 4, 1920–1928 (2011).
- , , & Resistant starch prevents colonic DNA damage induced by high dietary cooked red meat or casein in rats. Cancer Biol. Ther. 5, 267–272 (2006).
- , & Effect of resistant starch on colonic fermentation, bile acid metabolism, and mucosal proliferation. Dig. Dis. Sci. 39, 834–842 (1994).
- et al. Effects of resistant starch on the colon in healthy volunteers: possible implications for cancer prevention. Am. J. Clin. Nutr. 67, 136–142 (1998).
- , , , & Development and application of a polymerase chain reaction assay for the detection and enumeration of bile acid 7α-dehydroxylating bacteria in human feces. Clin. Chim. Acta 331, 127–134 (2003).
- et al. Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10-/- mice. Nature 487, 104–108 (2012).
- , , & Evidence that hydrogen sulfide is a genotoxic agent. Mol. Cancer Res. 4, 9–14 (2006).
- et al. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma. Genome Res. 22, 292–298 (2012).
- , , & Microbial pathways in colonic sulfur metabolism and links with health and disease. Front. Physiol. 3, 448 (2012).
- , , & Abnormal pattern of cell proliferation in the entire colonic mucosa of patients with colon adenoma or cancer. Gastroenterology 92, 704–708 (1987).
- et al. Classification and risk assessment of individuals with familial polyposis, Gardner's syndrome, and familial non-polyposis colon cancer from [3H]thymidine labeling patterns in colonic epithelial cells. Cancer Res. 44, 4201–4207 (1984).
- & Update on proliferation-associated antibodies applicable to formalin-fixed paraffin-embedded tissue and their clinical applications. Histochem. J. 25, 843–853 (1993).
- & Inflammation and cancer. Nature 420, 860–867 (2002).
- in Cancer Prevention II Springer181, 223–229 (2009).
- , & T-cell activation in the intestinal mucosa. Immunol. Rev. 215, 189–201 (2007).
- , & Intraepithelial lymphocytes: their shared and divergent immunological behaviors in the small and large intestine. Immunol. Rev. 215, 136–153 (2007).
- et al. Reduction of CD68+ macrophages and decreased IL-17 expression in intestinal mucosa of patients with inflammatory bowel disease strongly correlate with endoscopic response and mucosal healing following infliximab therapy. Inflamm. Bowel Dis. 19, 729–739 (2013).
- , , , , & Up-regulation of macrophage wnt gene expression in adenoma-carcinoma progression of human colorectal cancer. Br. J. Cancer 81, 496–502 (1999).
- et al. Monocyte chemoattractant protein 1 and macrophage cyclooxygenase 2 expression in colonic adenoma. Gut 55, 54–61 (2006).
- , , & The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition. Proc. Natl Acad. Sci. USA 111, 2247–2252 (2014).
- , & Relevance of protein fermentation to gut health. Mol. Nutr. Food Res. 56, 184–196 (2012).
- , & Intestinal protozoa are hypothesized to stimulate immunosurveillance against colon cancer. Med. Hypotheses 71, 104–110 (2008).
- et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 313, 1960–1964 (2006).
- , , , & Cancer immunoediting: from immunosurveillance to tumor escape. Nat. Immunol. 3, 991–998 (2002).
- , , , & Inhibition of histone-deacetylase activity by short-chain fatty acids and some polyphenol metabolites formed in the colon. J. Nutr. Biochem. 19, 587–593 (2008).
- Utilization of nutrients by isolated epithelial cells of the rat colon. Gastroenterology 83, 424–429 (1982).
- , , , , & The Warburg effect dictates the mechanism of butyrate-mediated histone acetylation and cell proliferation. Mol. Cell 48, 612–626 (2012).
- , & Butyrate and Wnt signaling: a possible solution to the puzzle of dietary fiber and colon cancer risk? Cell Cycle 7, 1178–1183 (2008).
- , , , , & Genotoxic effect of bile acids on human normal and tumour colon cells and protection by dietary antioxidants and butyrate. Eur. J. Nutr. 47, 301–309 (2008).
- et al. A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses. Nat. Med. 15, 1016–1022 (2009).
- & Dietary fibre for the prevention of colorectal adenomas and carcinomas (Review). The Cochrane Library, Issue 4 (2008).
- Diseases of the alimentary tract and western diets. Pathol. Microbiol. 39, 177–186 (1971).
- et al. Cancer burden in Africa and opportunities for prevention. Cancer 118, 4372–4384 (2012).
- et al. Comparative analysis of pyrosequencing and a phylogenetic microarray for exploring microbial community structures in the human distal intestine. PLoS ONE 4, e6669 (2009).
- et al. Richness of human gut microbiome correlates with metabolic markers. Nature 500, 541–546 (2013).
- , , & Microarray analysis and barcoded pyrosequencing provide consistent microbial profiles depending on the source of human intestinal samples. Appl. Environ. Microbiol. 77, 2071–2080 (2010).
- , , & Probabilistic analysis of probe reliability in differential gene expression studies with short oligonucleotide arrays. IEEE/ACM Trans. Comput. Biol. Bioinform. 8, 217–225 (2011).
- , , , & A fully scalable online pre-processing algorithm for short oligonucleotide microarray atlases. Nucleic Acids Res. 41, e110 (2013).
- In Bioinformatics and Computational Biology Solutions Using R and Bioconductor eds Gentleman R., Carey V., Dudoit S., R. Irizarry WH 397–420Springer (2005).
- & Statistical significance for genomewide studies. Proc. Natl Acad. Sci. USA 100, 9440–9445 (2003).
- , & in Proceedings of the 3rd International AAAI Conference on Weblogs and Social Media, 361–362 (San Jose, CA, USA, 2009).
- et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat. Protoc. 2, 2692–2703 (2007).
- et al. Recursive segment-wise peak alignment of biological (1)H NMR spectra for improved metabolic biomarker recovery. Anal. Chem. 81, 56–66 (2009).
- , , & Probabilistic quotient normalization as robust method to account for dilution of complex biological mixtures. Application in 1H NMR metabonomics. Anal. Chem. 78, 4281–4290 (2006).
- A direct approach to false discovery rates. J. R. Stat. Soc. B 64, 479–498 (2002).
Author information
Competing financial interests
The authors declare no competing financial interests.
Gerelateerde artikelen
- Specifieke darmbacteriën uit de darmflora - darmmicrobioom die ontstaan van overgewicht en zelfs obesitas voorspellen, zijn verschillend bij mannen en vrouwen
- De samenstelling van je poep - ontlasting zegt meer hoe oud je bent dan je verjaardag. Een gezonde darmflora - darmmicrobioom gaat gepaard met een gezond lichaam en omgekeerd.
- Microbioom - darmflora van de dunne darm (duodenale) blijkt significant veranderd bij personen met overgewicht en obesitas vergeleken met die bij mensen met een normaal gewicht.
- Darmbacterien beinvloeden werking van veel medicijnen, waaronder cholesterolverlagers, antidepressiva en de anticonceptiepil. Het microbioom - darmflora blijkt grote rol te spelen in onze gezondheid en immuunsysteem
- Poeptransplantatie onderdrukt en laat resistente bacterien verdwijnen bij chronisch zieke mensen met ziekte van Crohn, blijkt uit Nederlandse studie
- Specifieke bacterien in het microbioom - darmflora veroorzaken bepaalde ziektes of bevorderen juist gezondheid en microbioom kan stimulerende rol spelen bij immuuntherapie
- Darmkanker: Oorspronkelijk Afrikaans dieet verandert darmflora en ontlasting samenstelling in twee weken bij Afrikaanse mannen die Westers dieet gebruiken. Met gevolg minder risico op darmkanker.
- Darmflora en hersenas: Verstoring van de microbiota-darm-hersenas speelt een rol bij tal van hersenaandoeningen, zoals depressie en migraine. Probiotica kan hierin een rol spelen.
- Microbioom - Darmflora, een aantal artikelen bij elkaar gezet



Plaats een reactie ...
Reageer op "Darmkanker: Oorspronkelijk Afrikaans dieet verandert darmflora en ontlasting samenstelling in twee weken bij Afrikaanse mannen die Westers dieet gebruiken. Met gevolg minder risico op darmkanker."