Raadpleeg ook literatuurlijst niet-toxische middelen, voeding en behandelingen specifiek bij prostaatkanker van arts-bioloog drs. Engelbert Valstar.
Als donateur kunt u ook korting krijgen bij verschillende bedrijven, waaronder bij Medpro voor o.a. prostasol een veel gebruikt natuurlijk middel bij prostaatkanker als alternatief voor hormoontherapie.
28 oktober 2022: Zie ook deze informatie over jonge slapende geheugencellen die cruciale rol lijken te spelen bij immuuntherapie en vaccinaties.28 oktober 2022: Bron: ASCO 2022 en Journal of Clinical Oncology (met dank aan Marcel die mij dit artikel toestuurde)
Immuuntherapie met P-PSMA-101, een autologe CAR-T-celtherapie gericht op PSMA en de eiwitreceptoren aan de buitenkant van prostaatkankercellen, met een hoog percentage stamcelgeheugen T-cellen (TSCM), laat in een fase I studie bij 10 zwaar voorbehandelde patiënten met vergevorderde uitgezaaide hormoonresistente prostaatkanker veelbelovende resultaten zien. (Dit is het studieprotocol).
Drie patiënten vertoonden een afname van meer dan 50% in prostaatspecifiek antigeen (PSA) en werd bevestigd door een PSMA-PET-scan. Eén patiënt bereikte zelfs een bevestigde complete remissie bij de laagste dosis stamcelgeheugen T-cellen (TSCM) met bewijs van volledige tumordoding. Er traden weinig ernstige bijwerkingen op en als die zich voordeden konden die goed behandeld worden. Er werd geen neurotoxiciteit gezien.
"Dit innovatieve door Poseida PSMA aangestuurde CAR T-celplatform heeft een robuuste antitumorrespons aangetoond bij patiënten met uitgezaaide hormoonresistente prostaatkanker (mCRPC)", verklaarde Susan F. Slovin, MD, PhD, associate vice-voorzitter van Academic Administration bij Memorial Sloan Kettering Cancer Center en onderzoeksonderzoeker, in een persbericht. “Dit is de eerste keer dat ik zulke indrukwekkende reacties heb gezien met een immunotherapieproduct. De reacties van mijn patiënten in het onderzoek overtreffen mijn verwachtingen.”
P-PSMA-101 is ontworpen om zich specifiek te richten op het prostaatspecifiek membraanantigeen, dat tot expressie wordt gebracht op mCRPC-cellen.(zie ref. 2) Het middel is ontwikkeld met behulp van het piggyBac DNA-modificatiesysteem, dat producten vervaardigt met een hoger percentage stamcelgeheugencellen die T-celsubsets zoals effector-T-cellen, die een sleutelrol spelen bij de eliminatie van tumoren.
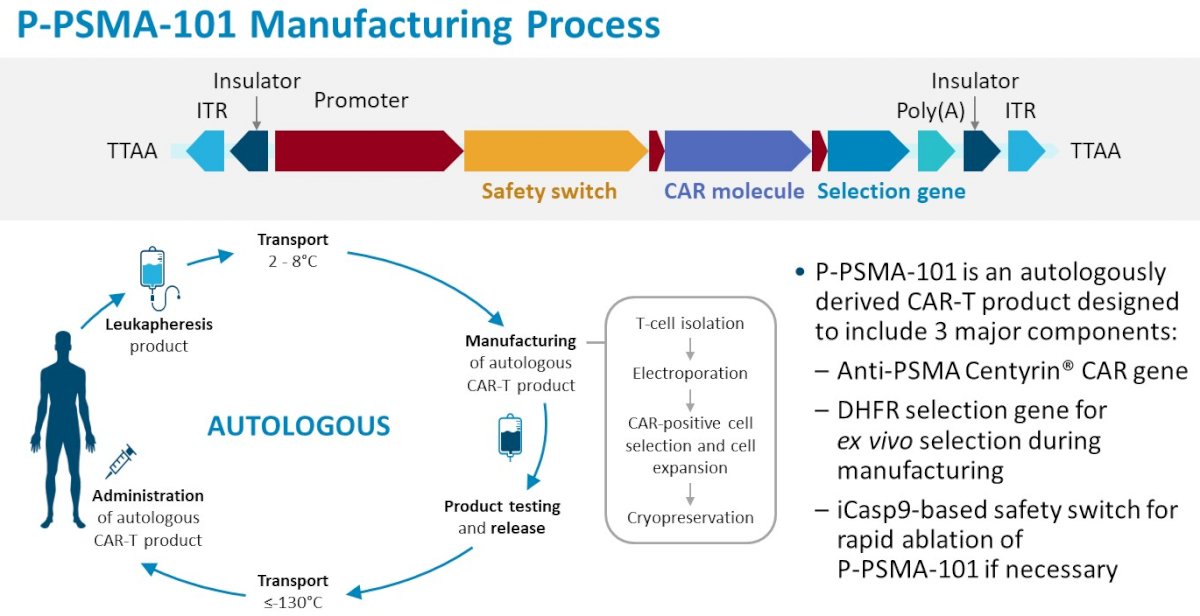
Een van de doelen van deze open-label, multicenter, 3+3 dosis-escalerende fase 1-studie was het vaststellen van de optimale dosis P-PSMA-101 die veilig kan worden gegeven aan patiënten met uitgezaaide hormoonresistente prostaatkanker (mCRPC). (zie ref.3).
Patiënten moesten mCRPC hebben die progressie van de ziekte bleef geven ondanks eerdere behandelingen voor gevorderde ziekte, een ECOG-prestatiestatus van 0 of 1,4 en acceptabele orgaanfunctie binnen vooraf bepaalde parameters. Ze mochten geen ernstige bijwerkingen van eerdere therapieën ervaren.
De primaire eindpunten van de studie waren het evalueren van de veiligheid van de CAR T-celtherapie, het bepalen van de maximaal getolereerde dosis en het onderzoeken van de werkzaamheid van het product. De deelnemers waren eerder zwaar voorbehandeld en hadden gemiddeld 6 eerdere behandelingen gehad met een mediane tijd van 6,4 jaar sinds de diagnose.
Zoals gezegd de eerste resultaten zijn veelbelovend. Hier het abstract van de studie zoals gepresenteerd op ASCO 2022.
References
- Poseida Therapeutics presents preliminary results from phase 1 trial of P-PSMA-101 at the 6th Annual CAR-TCR Summit. News release. Poseida Therapeutics, Inc. August 31, 2021. Accessed August 31, 2021. https://bit.ly/2WKV3lY
- Poseida Therapeutics announces dosing of first patient on phase 1 clinical trial of P-PSMA-01 autologous CAR-T for metastatic castration-resistant prostate cancer. News release. Poseida Therapeutics, Inc. May 20, 2020. Accessed August 31, 2021. https://bit.ly/3kQVjY5
- A phase I study of P-PSMA-01 CAR T-cell therapy in men with metastatic castration-resistant prostate cancer. Memorial Sloan Kettering Cancer Center. Accessed August 31, 2021. https://bit.ly/32iKLsn
- P-PSMA-01 CAR-T cells in the treatment of subjects with metastatic castration-resistant prostate cancer (mCRPC). ClinicalTrials.gov. Updated July 13, 2020. Accessed August 31, 2021. https://www.clinicaltrials.gov/ct2/show/NCT04249947
- Gergen MJ. Form 8-L: Poseida Therapeutics, Inc. United States Securities Exchange Commission. August 17, 2020. Accessed August 31, 2021. https://bit.ly/2CEl4cR
- Poseida Therapeutics announces clinical hold lifted on phase I autologous CAR-T study in prostate cancer. News release. Poseida Therapeutics, Inc. November 2, 2020. Accessed August 31, 2021. https://prn.to/385OmOE
Gerelateerde artikelen
- immuuntherapie met virustherapie CAN-2409 + valaciclovir in combinatie met radiotherapie geeft langere overal overleving + 30 procent en minder recidieven voor patienten met nieuwe diagnose van gelokaliseerde prostaatkanker
- Valacyclovir, een herpes medicijn plus een gemoduleerd virus naast radiotherapie en met of zonder hormoontherapie bij prostaatkankerpatienten geeft betere overleving (plus 20 procent) in vergelijking met historische statististische cijfers
- Ipilimumab plus nivolumab geeft bij moleculair geselecteerde castratieresistente prostaatkankerpatienten met gevorderde ziekte zeer goede respons en lange ziekteprogressievrije tijd bij patienten met mismatch repair deficiency
- AMG 509 - Xaluritamig, een bispecifiek antilichaam dat zich richt op het antigen STEP1 geeft bij zwaar voorbehandelde prostaatkankerpatienten hoopvolle resultaten
- anti-HER2 geactiveerde T-cellen (BAT's) naast pembrolizumab geeft bij patiënten met vergevorderde uitgezaaide hormoonresistente prostaatkanker alsnog goede resultaten op progressievrije ziekte en overall overleving
- Immuuntherapie met P-PSMA-101 = CAR-T-celtherapie gericht op PMSA geeft veelbelovende resultaten met zelfs een complete remissie bij 10 zwaar voorbehandelde patienten met vergevorderde uitgezaaide hormoonresistente prostaatkanker.
- Pembrolizumab plus olaparib geeft betere respons en ziekteprogressievrije overleving bij patiënten met eerder behandelde uitgezaaide prostaatkanker in vergelijking met abirateron of enzalutamide maar niet statistisch significant
- Immuuntherapie met pembrolizumab plus docetaxel en prednison geeft alsnog goede resultaten bij met abiraterone of enzalutamide voorbehandelde patiënten met uitgezaaide prostaatkanker
- Prostac-VF: immuuntherapie met gemodificeerd pokkenvirus geeft uitstekende resultaten op overleving en progressievrije tijd bij uitgezaaide hormoon resistente prostaatkanker
- ProscaVax, een vaccin bestaande uit een aan PSA gerelateerd eiwit samen met IL-2 en GM-CSF geeft 70 procent tumorvermindering bij recidief van prostaatkanker met oplopende PSA
- Weinig patienten met prostaatkanker hebben mutaties als microsatellite instability–high (MSI-H) of mismatch repair–deficinet (dMMR)maar als ze het hebben kan immuuntherapie met anti-PD medicijnen voor langdurige levensverlenging zorgen
- Immuuntherapie met pembrolizumab bij zwaar voorbehandelde prostaatkankerpatienten met uitgezaaide hormoonresistente ziekte geeft toch nog goede resultaten blijkt uit de Keynote-28 studie
- Immuuntherapie voor uitgezaaide hormoon resistente prostaatkanker. Een reviewstudie van recente ontwikkelingen
- Provenge een immuuntherapie met dendritische cellen bij prostaatkanker: een aantal artikelen bij elkaar gezet
- immuuntherapie met pembrolizumab - een anti-PD medicijn geeft onverwacht zeer goede resultaten na falen van enzalutamide bij patienten met vergevorderde uitgezaaide prostaatkanker.
- Immuuntherapie met dendritische celtherapie voor patiënten met uitgezaaide hormoon resistente prostaatkanker nog open voor patienten
- Immuuntherapie: Drie nieuwe studies bewijzen waarde van immuuntherapie bij gevorderde uitgezaaide hormoonresistente prostaatkanker, er wordt zelfs over genezende aanpak gesproken
- Erasmus Medisch Centrum start fase I studie met oncolitisch virus bij niet uitgezaaide lokale prostaatkanker
- Dendritische celtherapie bij prostaatkanker: overzichtstudie is positief over deze aanpak, maar vraagt meer onderzoek naar combinaties van dendritische cellen met tumor gerelateerde antigenen - eiwitten en in combinatie met andere behandelingswijzen.
- Dendritische celtherapie bij prostaatkanker: Amerikaanse studie heeft studie gestart in 2008 gepromoveerd tot fase II studie
- Combinatie van hormoontherapie met een gen - en immuuntherapie in de vorm van een vaccin - dendritische celtherapie voor mannen met uitgezaaide prostaatkanker gestart in VUMC en voortgezet in Amerika
- Vaccin tegen prostaatkanker blijkt effectief tonen dierstudies aan.
- Squalamine is een natuurlijke angiogeneseremmer ter voorkoming van een recidief van prostaatkanker en andere vormen van kanker. Een overzichtstudie.
- Meta analyse (overzicht van gerandomiseerde studies) toont aan dat immuuntherapie voor hoopvolle resultaten zorgt waarbij dendritische celtherapie eruit springt als meest zinvolle aanpak.
- Injecties met Gc-MAF een vitamine D verbindend eiwit werkt uiterst effectief (100% genezing bij totaal 16 prostaatkankerpatienten) als vernietiging en bescherming tegen terugkeer van prostaatkanker.
- Immuuntherapeutische aanpak, waaronder dendritische celtherapie bij prostaatkanker: een overzicht van belangrijke studies en recente ontwikkelingen.



Plaats een reactie ...
Reageer op "Immuuntherapie met P-PSMA-101 = CAR-T-celtherapie gericht op PMSA geeft veelbelovende resultaten met zelfs een complete remissie bij 10 zwaar voorbehandelde patienten met vergevorderde uitgezaaide hormoonresistente prostaatkanker."