11 februari 2015: Bron: Traina TA, et al: San Antonio Breast Cancer Symposium. Abstract P5-19-09. Presented December 12, 2014.
Enzalutamide (Xtandi) - een hormoonblokker - geeft spectaculaire en hoopgevende resultaten bij borstkankerpatiënten met gevorderde triple negatieve borstkanker met een positieve expressie van de hormoonreceptor AR, maar die nooit goed reageerden op een hormoontherapie of deze nooit hebben gehad omdat de estrogeen receptor - ER negatief was. Van de patiënten met enige AR positieve receptorexpressie kwamen zelfs enkele patienten binnen een half jaar in een totale remissie.
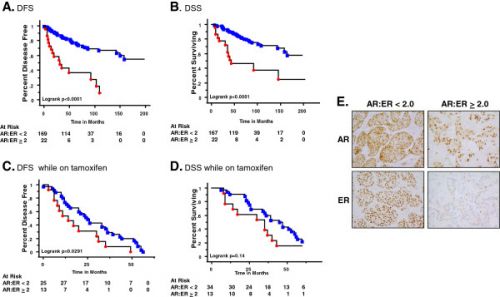
Bij patienten met positieve AR hormoonreceptorexpressie, was de mediane progressie vrije overleving 2.5 keer zo groot dan voor diagnostisch negatieve patiënten (20 vs 8 weken) en het klinische voordeel op 24 weken lag bij diagnostisch positieve patiënten tussen de 42%–60%, dit is vergelijkbaar met hormoontherapie bij hormoongevoelige borstkanker (ER-pos.).
Dit blijkt uit een internationale fase II studie bij totaal inmiddels 118 deelnemende patiënten gepresenteerd op het San Antonio Breast Cancer Symposium 2014.
Enzalutamide is een medicijn dat zich direct bindt aan de androgeenreceptor en is daarmee een krachtige remmer van de hormoonproductie . Enzalutamide is al goedgekeurd als medicijn bij uitgezaaide hormoon resistente prostaatkanker.
Clifford A. Hudis, MD, FACP, van het Memorial Sloan Kettering Cancer Center, New York, een van de onderzoekers van de studie, geeft commentaar op de bevindingen van deze studie en het potentieel van dit medicijn in deze subgroep van patiënten.
“We zijn er al jaren van overtuigd dat hormoonblokkers een rol zouden kunnen spelen bij patiënten met triple negatieve borstkanker maar die wel een expressie laten zien van de hormoonreceptor - AR.”
"Enzalutamide is een moderner medicijn met meer potentie dan bv. bicalutamide (werkzame stof in casodex) en heeft aangetoond een veel sterkere binding te hebben met de hormoonreceptor. Casodex - Bicalutamide is al jaren goedgekeurd voor prostaatkanker en heeft ook enige activiteit aangetoond bj borstkanker.2
“We vroegen ons dan ook af of enzalutamide wellicht ook een respons zou kunnen geven bij borstkanker en in het tijdperk van personalised medicine past dan ook deze studie,” zegt Dr. Hudis.
“Hoewel het hier gaat om een kleine subgroep van patienten —20% to 40% is van het triple-negatieve subtype, welke op haar beurt een klein percentage is van alle vormen van borstkanker — zien we dat enzalutamide gegeven kan worden aan deze groep van patiënten waarvoor in principe standaard chemotherapie wordt gegeven. En zagen we ook dat deze een effectiveit liet zien in de palliatieve setting (pijnstillend, betere kwaliteit van leven) en zelfs gedeeltelijke remissies liet zien met milde en beperkte bijwerkingen.” Aldus dr. Hudis op het San Antonio Breast Cancer Symposium 2014.
Fase II studie opzet en resultaten:
De studie onderzocht 404 patiënten met gevorderde triple-negatieve borstkanker en 118 deelnemers toonden enige expressie van de hormoonreceptor (AR = > 2% expressie; ER = 0% expressie). Patiënten werden tot progressie van de ziekte behandeld met alleen enzalutamide met een dosis van 160 mg per dag. Het primaire eindpunt was klinisch voordeel na 16 weken bij evalueerbare patiënten, dat wil zeggen die met een AR expressie van ≥ 10% van de tumor en ten minste één tumorbeoordeling na de basismeting bij de start van de behandeling.
Fase 1 van de studie omvatte 42 patiënten (n=42); de studie vereist dat ten minste 3 van 26 evalueerbare patiënten klinisch voordeel zouden verkrijgen, (dwz volledige respons, gedeeltelijke respons of stabiele ziekte) om te worden uitgebreid tot fase 2. In fase 2 (n = 76) van de studie, moesten ten minste 9 van 62 evalueerbare patiënten voldoen aan het einddoel, .
Resultaten:
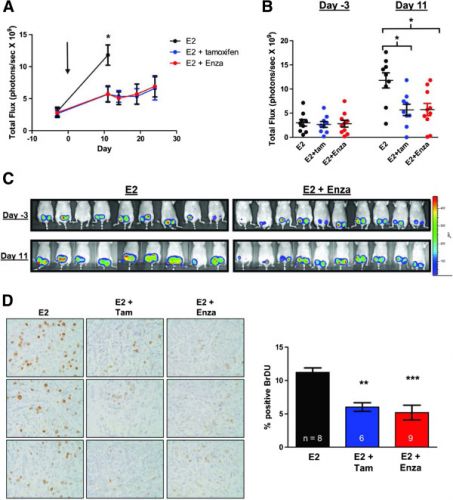
In de huidige analyse van de fase 1 patiënten, heeft alleen een behandeling met enzalutamide aangetoond sterke antitumor activiteit te bewerkstelligen, met een klinisch voordeel op een meting na 16 weken bij 42% van 26 evalueerbare patiënten (24% in de intent-to-treat populatie). Van deze patiënten behield 82% klinisch voordeel op een meting na 24 weken. Bovendien werden met alleen een anti-androgene receptor therapie met enzalutamide een grote respons waargenomen," meldde Tiffany A. Traina, MD, van het Memorial Sloan Kettering Cancer Center, eerste auteur van de studie.
Twee patiënten in de fase 1 hadden een volledige of gedeeltelijke remissie. In fase 2, heeft een extra patiënt tot nu toe een volledige remissie bereikt, en nog drie hebben een gedeeltelijke remissie bereikt. Wijzend naar CT-scan beelden op de poster van een patiënt behandeld in het Memorial Sloan Kettering, zegt Dr. Traina: "Ze had een duidelijke, bevestigde remissie na viscerale metastasen en meerdere organen met tumoren. Het was een echte totale remissie en ze is nog steeds onder behandeling."
Novel Diagnostic Assay
“Het is mogelijk om patiënten te screenen op gevoeligheid voor enzalutamide ,” aldus Dr. Traina. Een nieuwe biomarker test methode is getest en investeerders concluderen dat deze superieur is aan immunohistochemistry - klassieke pathologie.” Maar de test wordt niet bij naam genoemd.
Bij patienten met positieve AR hormoonreceptorexpressie, was de mediane progressie vrije overleving 2.5 keer zo groot dan voor diagnostisch negatieve patiënten (20 vs 8 weken) en het klinische voordeel op 24 weken lag bij diagnostisch positieve patiënten tussen de 42%–60%, dit is vergelijkbaar bij hormoontherapie bij hormoongevoelige borstkanker (ER-pos.).
Ca. 50% van de intent-to-treat populatie was diagnostisch-positief door deze methode. Verder onderzoek is gaande bij patiënten binnen de fase 2 studie.
Dr. Traina voegt eraan toe dat voor de patiënten met een positief diagnostisch profiel en behandeld in de eerste of tweede fase van de studie een therapeutisch effect van 60% op een meting na 24 weken werd aangetoond. "Dit is fenomenaal voor een hormoontherapie bij triple negatieve borstkanker."
Enzalutamide werd goed verdragen. Bijwerkingen waren primair milde tot gemiddelde vermoeidheid en soms spijsverteringsproblemen en waren vergelijkbaar met de bijwerkingen die gezien worden bij andere hormoonbehandelingen. 7% van de patiënten stopte de behandeling door de ernst van de bijwerkingen. (Red: ik wil daar bij opmerken dat alle patiënten in stadium 4 verkeerden van hun borstkanker en waarschijnlijk sowieso veel last hadden van allerlei klachten samenhangend met hun ziekte.)
Dit is de grootste prospectieve klinische studie uitgevoerd bij patiënten met triple negatieve borstkanker met een AR positieve expressie. Eindresultaten van de 118 patiënten worden verwacht in de loop van 2015.
Disclosure: Dr. Traina reported that she is a consultant for Genentech, Eisai, Halozyme, Celgene, and Prostrakan and has received research support from Medivation, AstraZeneca, Eisai, Janssen, Genentech, and Novartis. Dr. Hudis reported no potential conflicts of interest.
References
1. Traina TA, et al: San Antonio Breast Cancer Symposium. Abstract P5-19-09. Presented December 12, 2014.
2. Gucalp A, et al: Clin Cancer Res 19:5505-5512, 2012.
Het abstract van de presentatie van deze studie: Data Presented from Phase 2 Study of Enzalutamide In Advanced Androgen-Receptor Positive, Triple-Negative Breast Cancer kunt u vinden op de website van de producent van Enzalutamide.
Hieronder dit abstract:
Enzalutamide Shows Encouraging Activity in Triple‑Negative Breast Cancer
Data Presented from Phase 2 Study of Enzalutamide In Advanced Androgen-Receptor Positive, Triple-Negative Breast Cancer
Dec 12, 2014
SAN FRANCISCO, CA and TOKYO – December 12, 2014 – Medivation, Inc. (Nasdaq: MDVN) and Astellas Pharma Inc. (Tokyo: 4503), announced today the presentation of Stage 1 and preliminary Stage 2 data from a Phase 2 study evaluating the use of enzalutamide as a single agent for the treatment of advanced androgen receptor positive (AR+), triple negative breast cancer (TNBC). Data was presented at the 37th Annual San Antonio Breast Cancer Symposium.
Title: Stage 1 Results from MDV3100-11: A 2-Stage Study of Enzalutamide (ENZA), an Androgen Receptor (AR) Inhibitor, in Advanced AR+ Triple-Negative Breast Cancer (TNBC) (Abstract # P5-19-09).
Patients with any amount of AR staining by immunohistochemistry could be enrolled in the study (n=42 in Stage 1, n=118 in total). The primary endpoint was clinical benefit rate, defined as the portion of Evaluable patients (≥10% AR staining in tumor cells and a post-baseline assessment) who had a complete response, partial response, or stable disease for at least 16 weeks. There was no limit to prior therapy. In Stage 1, 26 of the 42 enrolled women comprised the Evaluable population.
- In the 26 Evaluable women, the primary endpoint was achieved in 42% (11 of 26) including 1 partial response in a patient with measurable disease and 1 complete response in a patient with non measurable disease. Clinical benefit rate ≥24 weeks was achieved in 35% (9 of 26).
- The clinical benefit rate > 16 weeks in Stage 1 was sufficiently high to enable both the expansion into Stage 2 and early rejection of the null hypothesis.
- While data are not yet mature (anticipated 2015), 1 additional complete response and 3 additional partial responses have been observed to date in the additional 76 patients enrolled following Stage 1, for a total of 6 complete or partial responses in both Stages as of November 10, 2014.
The most common adverse events reported in the Stage 1 intent to treat population (n=42) were fatigue (36%), nausea (33%), diarrhea (21%), decreased appetite (21%), back pain (14%), headache (14%), hot flush (12%), insomnia (12%), vomiting (12%), pain (12%) and constipation (12%). To date, the safety and tolerability profile of the additional patients enrolled in Stage 2 are consistent with the profile seen in Stage 1. Patients will continue to be monitored for safety.
“The combined results from Stage 1 and 2 suggest that enzalutamide may provide a potential benefit to women with advanced androgen-receptor positive, triple-negative breast cancer,” said Tiffany A Traina, M.D., primary investigator of the study and medical oncologist, Memorial Sloan Kettering Cancer Center. “This is encouraging for patients with this type of breast cancer because it is a particularly challenging subtype of the disease, for which the only available treatment option is chemotherapy.”
Androgen-receptor positive TNBC is a recently-identified subtype that can express high levels of the androgen receptor. This Phase 2 study of single agent enzalutamide is the largest to date in patients with AR+ TNBC and the first to report objective responses to a hormonal therapy.
TNBC remains an area of significant unmet medical need. Currently, there are no approved targeted therapies for these patients, who are typically treated with multiple regimens of chemotherapy.
About the Phase 2 Study
The Phase 2 open label, single-arm study was initiated in June 2013 and completed enrollment in July 2014. 118 patients were enrolled in 2 Stages at sites in the United States, Canada and Europe. The primary endpoint of the trial is clinical benefit rate, defined as the proportion of patients with a best response of complete response, partial response or stable disease at ≥ 16 weeks. All patients receive enzalutamide at a dose of 160 mg to be taken orally once daily.
Enzalutamide Mechanism of Action
Enzalutamide is an androgen receptor inhibitor that acts on multiple steps in the androgen receptor signaling pathway within the tumor cell. In preclinical studies, enzalutamide has been shown to competitively inhibit androgen binding to androgen receptors, and inhibit androgen receptor nuclear translocation and interaction with DNA. Clinical significance is unknown.
About XTANDI® (enzalutamide) capsules
XTANDI is approved by the U.S. Food and Drug Administration for the treatment of patients with metastatic castration-resistant prostate cancer (CRPC).
Important Safety Information
Contraindications: XTANDI (enzalutamide) capsules can cause fetal harm when administered to a pregnant woman based on its mechanism of action and findings in animals. XTANDI is not indicated for use in women. XTANDI is contraindicated in women who are or may become pregnant.
Warnings and Precautions: In Study 1, conducted in patients with metastatic castration-resistant prostate cancer (CRPC) who previously received docetaxel, seizure occurred in 0.9% of patients who were treated with XTANDI and 0% treated with placebo. In Study 2, conducted in patients with chemotherapy-naïve metastatic CRPC, seizure occurred in 0.1% of patients who were treated with XTANDI and 0.1% treated with placebo. Patients experiencing a seizure were permanently discontinued from therapy and all seizure events resolved. There is no clinical trial experience re‐administering XTANDI to patients who experienced a seizure, and limited clinical trial experience in patients with predisposing factors for seizure. Study 1 excluded the use of concomitant medications that may lower threshold, whereas Study 2 permitted the use of these medications. Because of the risk of seizure associated with XTANDI use, patients should be advised of the risk of engaging in any activity during which sudden loss of consciousness could cause serious harm to themselves or others. Permanently discontinue XTANDI in patients who develop a seizure during treatment.
Adverse Reactions: The most common adverse reactions (≥ 10%) reported from the two combined clinical trials that occurred more commonly (≥ 2% over placebo) in the XTANDI-treated patients were asthenia/fatigue, back pain, decreased appetite, constipation, arthralgia, diarrhea, hot flush, upper respiratory tract infection, peripheral edema, dyspnea, musculoskeletal pain, weight decreased, headache, hypertension, and dizziness/vertigo.
Other Adverse Reactions include:
• Laboratory Abnormalities: In the two studies, Grade 1‐4 neutropenia occurred in 15% of patients treated with XTANDI (1% Grade 3-4) and in 6% of patients treated with placebo (0.5% Grade 3-4). The incidence of Grade 1‐4 thrombocytopenia was 6% of patients treated with XTANDI (0.3% Grade 3-4) and 5% of patients on placebo (0.5% Grade 3-4). Grade 1-4 elevations in ALT occurred in 10% of patients treated with XTANDI (0.2% Grade 3-4) and 16% of patients treated with placebo (0.2% Grade 3-4). Grade 1-4 elevations in bilirubin occurred in 3% of patients treated with XTANDI (0.1% Grade 3-4) and 2% of patients treated with placebo (no Grade 3-4).
• Infections: In Study 1, 1% of XTANDI versus 0.3% of placebo patients and in Study 2, 1 patient in each treatment group (0.1%) had an infection resulting in death.
• Falls: In the two studies, falls including fall‐related injuries occurred in 9% of XTANDI patients vs 4% treated with placebo. Falls were not associated with loss of consciousness or seizure. Fall‐related injuries were more severe in XTANDI patients and included non‐pathologic fractures, joint injuries, and hematomas.
• Hypertension: In the two studies, hypertension was reported in 11% of patients receiving XTANDI and 4% of patients receiving placebo. No patients experienced hypertensive crisis. Medical history of hypertension was balanced between arms. Hypertension led to study discontinuation in < 1% of XTANDI or placebo treated patients.
Drug Interactions:
• Effect of Other Drugs on XTANDI ‐ Administration of strong CYP2C8 inhibitors can increase the plasma exposure to XTANDI. Co‐administration of XTANDI with strong CYP2C8 inhibitors should be avoided if possible. If co‐administration of XTANDI cannot be avoided, reduce the dose of XTANDI. Co‐administration of XTANDI with strong or moderate CYP3A4 and CYP2C8 inducers may alter the plasma exposure of XTANDI and should be avoided if possible.
• Effect of XTANDI on Other Drugs ‐XTANDI is a strong CYP3A4 inducer and a moderate CYP2C9 and CYP2C19 inducer in humans. Avoid CYP3A4, CYP2C9 and CYP2C19 substrates with a narrow therapeutic index, as XTANDI may decrease the plasma exposures of these drugs. If XTANDI is co‐administered with warfarin (CYP2C9 substrate), conduct additional INR monitoring.
For Full Prescribing Information for XTANDI (enzalutamide) capsules, please visit www.XtandiHCP.com/PI
Gerelateerde artikelen
- Studiepublicaties van niet-toxische middelen en behandelingen uit literatuurlijst van arts-bioloog drs. Engelbert Valstar, gerelateerd aan borstkanker copy 1
- ESMO 2023: aanbevolen abstracten voor borstkanker door oncologen en borstkankerspecialisten
- ASCO 2024: aanbevolen abstracten gerelateerd aan borstkanker door vooraanstaande oncologen wereldwijd
- 177Lu-FAP-2286 geeft uitstekende resultaten bij zwaar voorbehandelde patienten met vergevorderde uitgezaaide hormoongevoelige borstkanker waar verder geen behandelingsopties meer voorhanden waren
- Algemeen: Borstkanker korte algemene informatie
- Aprepitant, een antibraak middel bij chemotherapie, blijkt betere ziektevrije overleving op afstand en borstkankerspecifieke overleving te geven bij borstkankerpatienten met borstkanker in vroeg stadium
- Arimidex - anastrozole informatie en studie overzicht
- Arimidex: 2 jaar aromataseremmers na hormoontherapie bij borstkanker geeft dezelfde overall overleving als 5 jaar. Veel borstkankerpatienten worden overbehandeld. copy 1
- Artemisinin - Armesia: informatie over Artemisinin, als medicijn succesvol bij malaria maar ook als aanvullend middel bij vormen van kanker waaronder borstkanker bij elkaar gezet.
- Avastin in combinatie met verschillende vormen van chemo bij borstkanker geeft langere ziektevrije tijd maar geen verschil in mediane overlevingstijd noch in overall overlevingen. FDA trekt goedkeuring definitief in
- Bestraling bij borstkanker: een overzicht van belangrijke artikelen en recente studies.
- Bisfosfonaten geven een betere algehele overleving en borstkankerspecifieke overleving bij oudere vrouwen (+65 jaar). Denosumab geeft geen extra verbetering van overall overleving.
- Boeken gerelateerd aan borstkanker
- Buparsilib een PI3K remmer naast fulvestrant geeft 30 tot 50 procent langere ziekteprogressievrije tijd maar wel meer bijwerkingen bij gevorderde borstkanker copy 1
- Chemo bij borstkanker: hier een overzicht van belangrijke artikelen en recente studies bij elkaar gezet.
- Chinese kruiden verbeteren bijna altijd de effecten van chemo en verminderen eigenlijk altijd de bijwerkingen ervan. Klik hier voor artikelen over TCM - Traditionele kruiden.
- ctDNA - circulerend DNA in bloed meten geeft betere prognose op resultaten en effectiviteit van behandelingen bij borstkanker type HER2 positief dan complete remissies
- Datopotamab deruxtecan geeft bij patiënten met inoperabele of uitgezaaide lokale triple-negatieve borstkanker voor wie immuuntherapie geen optie was uitstekende resultaten in vergelijking met chemotherapie
- Dendritische celtherapie. Ook geschikt voor borstkanker.
- Denosumab injecties geven ook bij borstkanker uitstekende resultaten tegen botuitzaaiingen
- Diagnose en oorzaken van borstkanker: een overzicht van artikelen en recente ontwikkelingen.
- Enzalutamide - Xtandi geeft spectaculaire resultaten bij gevorderde triple negatieve borstkanker (stadium 4) met ook een positieve expressie van de hormoonreceptor. copy 1
- Eierstokken weghalen naast standaard behandelingen van chemo, borstoperatie, bestraling, hormoontherapie geeft 40 procent betere overleving voor vrouwen met BRCA2-gemuteerde borstkanker stadium I – III
- Eribuline mesylaat is net zo effectief of beter dan chemo als eerste- of tweedelijnsbehandeling voor lokaal gevorderde of uitgezaaide borstkanker
- Ervaringsverhalen Borstkanker: Vrouw van 29 jaar met triple negatieve borstkanker stadium IV komt in complete remissie door aanvullend op chemo persoonlijke voedingsadviezen (kytogeen dieet), hyperthermie en hyperbare zuurstoftherapie copy 1 copy 1
- Everolimus (Afinitor) plus hydroxychloroquine doodt slapende tumorcellen bij borstkankerpatienten en geeft zeer goede ziektevrije overleving en overall overlevingsresultaten van 85 tot 100 procent blijkt uit de fase II studie CLEVER.
- Exemestane - Aromasin als behandelings medicijn bij vrouwen met borstkanker in de leeftijd na de overgang..
- Gebapentin een niet hormonaal medicijn effectief tegen opvliegers bij vrouwen met borstkanker. die een hormoon behandeling volgen.
- Genentest: Oncotype DX - Genetest voorspelt kansen op recidief bij hormoongevoelige borstkanker met geen uitzaaiingen door behandeling met chemokuren. Aldus twee tienjarige studies gepubliceerd in de NEJM - New England Journal of Medicin
- Herceptin - Trastuzumab bij borstkanker: een overzicht van recente ontwikkelingen en belangrijke artikelen en studies
- Hormoontherapie plus CDK 4/6 remmers geeft beste resultaten op progressievrije ziekte en overall overleving voor patienten met borstkanker met hormoongevoelige uitgezaaide borstkanker en HER-2 neg. in vergelijking met alleen hormoontherapie of chemo.
- Hyperthermie geeft significant betere resultaten bij verschillende kankersoorten en vooral bij borstkankerpatienten die eerder bestraald zijn.
- Immuuntherapie bij borstkanker, een overzicht
- Iressa - gefinitib toegevoegd aan arimidex - anastrozol geeft langere ziektevrije tijd en mediane overleving voor patienten met hormoongevoelige borstkanker. Artikel geplaatst 1 april 2010
- Lapatinib - Tykerb naast herceptin - trastuzumab geeft significant langere ziektevrije tijd en betere overall overleving dan alleen herceptin bij patienten met borstkanker met positieve Her2-Neu expressie, maar faalt bij beginnende borstkanker
- Lipidenverlagende medicijnen (LLM) (statines) hebben gunstige invloed op overall overleving van kankerpatienten met borstkanker, darmkanker en melanomen. copy 1
- LITT behandeling - Laser-induced Interstitial Thermotherapy - bij borstkanker geeft ook significant betere en langere overlevingstijd bij levertumoren vanuit borstkanker
- Lymfoedeem ontstaan direct na een operatie van okselklieren, na bestraling van de oksel ontstaat lymfoedeem vaak enkele jaren later..
- Mammaprint - een genentest die kan voorspellen welke behandeling een borstkankerpatient nodig heeft.
- Mammastatin: Is mammastatin de nieuwste doorbraak bij borstkanker? Een bepaald eiwit zou effect van visolie bij borstkanker zodanig stimuleren dat ontwikkeling van borstkankercellen wordt gestopt en zelfs vernietigd.
- NABON - Nationaal Borstkanker Overleg Nederland stelt: overgrote deel van Nederlandse ziekenhuizen - 85% - voldoet niet aan de norm tot een adekwate behandeling en zorg voor borstkankerpatiënten binnen een daarvoor gestelde termijn.
- Newcastle virus: Dierproeven met Newcastlevirus bij borstkankerpatiënten HER2-Neu bepaald lijken hoopvol.
- Oorzaak borstkanker: Gen ontdekt dat mogelijk rol speelt bij ontstaan van borstkanker
- Operatie: aantal artikelen over operatie technieken en gevolgen van operatieve ingrepen bij borstkanker bij elkaar gezet
- Opvliegers tijdens ziekte blijken betere prognose op genezing van borstkanker te geven en geven bijna 50 procent minder kans op een recidief. 12,9 procent tegenover 21 procent..
- Osteoporose - botontkalking bij borstkanker: Hormoontherapie anders dan met tamoxifen geeft groter risico op botontkalking bij borstkankerpatiënten, ook als ze borstkanker overleven.
- Overlevenden van borstkanker hebben sterk verhoogd risico - 25 procent - op krijgen van andere vormen van kanker dan borstkanker in vergelijking met de doorsnee bevolking
- PARP remmers als monotherapie voor BRCA-1 en BRCA 2 pos. plus HER2-neg. uitgezaaide borstkanker geeft wel langere progressievrije ziekte maar geen verschil in overall overleving in vergelijking met chemotherapie
- Patientenervaringen: Borstkanker - Casestudies
- PDT - Photo Dynamische Therapie kan ook bij borstkanker:een optie zijn, vooral die eerder al geopereerd en bestraald zijn.
- Prof. dr. Pinedo over aanpak van borstkanker en andere solide tumoren. Lezing uit 2001. Nieuwe gegevens over GM-GSF studies toegevoegd.
- Pyrotinib na falen van lapatinib (Tykerb) kan toch nog behandelingsoptie zijn voor patiënten met HER2-positieve uitgezaaide borstkanker, zelfs bij hersenmetastases
- Radium-223, bij prostaatkanker effectief, lijkt ook voor in botten uitgezaaide borstkanker een uitstekend medicijn
- RFA - Radio Frequency Ablation bij borstkanker: enkele artikelen bij elkaar gezet.
- Sacituzumab tirumotecan (Trodelvy) geeft alsnog uitstekende resultaten bij patienten met voorbehandelde triple negatieve borstkanker waar hormoontherapie resistentie optrad in vergelijking met chemotherapie
- Sacituzumab govitecan (Trodelvy) een anti-lichaam medicijn geeft zeer goede resultaten bij borstkankerpatiënten met voorbehandelde uitgezaaide triple-negatieve borstkanker met TROP-2 mutatie in vergelijking met chemotherapie
- Schildwachtkliermethode bij borstkanker
- Siliconen en risico op borstkanker geven siliconen nu wel of niet een groter risico op borstkanker? Hier een uitgebreide analyse en historisch overzicht.met veel studies die ernaar gedaan zijn
- Sonia studie: Borstkanker wordt vaak overbehandeld. Erasmus MC doet daar wat aan via de Sonia studie. copy 1
- Stamcelbehandeling (autologous stem cell rescue) plus chemokuren bij borstkanker geven superieure overleving t.o.v. een enkele stamcelbehandeling.
- TACE - Transarteriële chemo-embolisatie - bij borstkankerpatiënten voor hun leveruitzaaiïngen verlengt het leven van deze patiënten significant.
- TACP - Trans Arteriële Chemo Perfusie geeft bij gevorderde uitgezaaide borstkanker nog betere resultaten dan bij darmkanker copy 1
- Tetracycline bij verschillende vormen van kanker als botversterker en bestrijder van kanker in de botten lijkt een interessant middel.
- Ultra Sound - opereren via geluid en verhitting - wordt ingezet bij beginnende borstkanker in het UMC - Utrecht copy 1
- Vermoeidheid bij overlevenden van borstkanker: 32% van de vrouwen die borstkanker overleven heeft tot minimaal tien jaar na de diagnose last van ernstige vermoeidheidsverschijnselen blijkt uit tienjarige grote studie
- Zelfonderzoek naar borstkanker leidt niet tot langere overlevings duur maar wel tot grotere medicalisering.
- Zometa - Zoledronic acid informatie bij elkaar gezet.
- Reguliere behandelingen, medicijnen en middelen bij borstkanker: een overzicht



Plaats een reactie ...
Reageer op "Enzalutamide - Xtandi geeft spectaculaire resultaten bij gevorderde triple negatieve borstkanker (stadium 4) met ook een positieve expressie van de hormoonreceptor. copy 1"