14 juli 2025: zie ook deze artikelen: https://kanker-actueel.nl/immuuntherapie-met-het-vaccin-dcvax-geeft-uitstekende-resultaten-op-overall-overleving-bij-glioblastoma-multiforme-gegeven-bij-nieuwe-diagnose-na-operatie-blijkt-uit-fase-3-studie.html
14 juli 2025: Bron: 2024 Feb 21;25(5):2529. En lume 617, 1 May 2025, 217601
Een van de moeilijkst te behandelen vormen van kanker zijn kwaadaardige hersentumoren en dan is de gevaarlijkste en tot nu toe bijna altijd dodelijk binnen paar jaar na de diagnose een hersentumor van het type Glioblastoom. Toch wordt vooruitgang geboekt vooral met vormen van Immuuntherapie zoals deze recente studie nog laat zien.
Vorig jaar en recent nog dit jaar d.d. 1 mei 2025 zijn er twee meta-analyses verschenen die een overzicht geven van de behandelingen die hoopgevende resultaten laten zien. Met als naar voren gehaalde kernpunten:
Kernpunten van deze overzichtstudies:
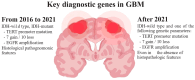
- Glioblastoom wordt veroorzaakt door genetische mutaties, ontregelde signaalroutes en een vijandige tumormicro-omgeving.
- De neurowetenschappen van kanker bieden inzicht in de wisselwerking tussen kanker en zenuwen, die de progressie van Glioblastoom beïnvloedt.
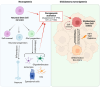
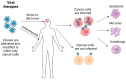
- Immuuntherapie, oncolytische virale therapieën en kankervaccins bevinden zich in de klinische fase.
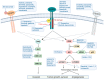
- Via DNA onderzoek gevonden signaalroutes die betrokken zijn bij het ontstaan en progressie van Glioblastoom moeten worden onderzocht bij het ontwikkelen van therapieën voor Glioblastoom.
- Multi-omics-profilering, biomarkergestuurde therapie en combinatietherapieën zullen naar verwachting de prognose van Glioblastoom verbeteren.
Samenvatting:
- Gezien de mediane overleving van slechts ongeveer 12-15 maanden, de slechte prognose en een gebrek aan effectieve therapeutische medicatie, is de behandeling/het controleren van Glioblastoom een lastige opgave gebleken.
- Chirurgische resectie - operatie, aangevuld door radiotherapie en chemotherapie met temozolomide (Temodal), geldt als de standaardbehandeling; deze driedelige therapie is echter vaak beperkt effectief vanwege de heterogene en sterk infiltrerende aard van Glioblastoom-cellen. Bovendien belemmeren het bestaan van de bloed-hersenbarrière, de tumormicro-omgeving en de immuunonderdrukkende aard van Glioblastoom, samen met de ervaren resistentie van Glioblastoom-cellen tegen conventionele therapie, de therapeutische toepassingen van chemotherapeutica bij Glioblastoom.
- Deze review presenteert belangrijke inzichten in de moleculaire pathologie van Glioblastoom, waaronder genetische mutaties, signaalroutes en kenmerken van de tumormicro-omgeving.
- Recente innovaties zoals Immuuntherapie, oncolytische virale therapieën, vaccins, nanotechnologie, elektrische velden en kankerneurowetenschappen, evenals hun klinische vooruitgang, zijn besproken.
- Daarnaast bevat deze meta-analyse ook een discussie over de rol van gepersonaliseerde geneeskunde bij het afstemmen van behandelingen op basis van individuele tumorprofielen, een aanpak die geleidelijk aan een paradigmaverschuiving in de behandeling/het controleren van Glioblastoom veroorzaakt.
- Gesterkt door de lessen die zijn geleerd uit eerdere mislukkingen, gecombineerd met de drang om nieuwe/multidisciplinaire benaderingen te omarmen, lijken onderzoekers op de goede weg te zijn om effectievere en duurzamere oplossingen te vinden voor de behandeling van hersentumoren van het type Glioblastoom.
Achtereenvolgens de abstracten van de twee meta-analyses die beiden gratis toegankelijk zijn met meer dan 1100 referenties:
Vooruitgang in de behandelingen van hersentumoren met het type glioblastoom: leren uit het verleden en hoopvolle nieuwe behandelingen voor de toekomst
Cancer Letters
Advancing glioblastoma therapy: Learning from the past and innovations for the future
Het doel van dit overzicht is om de vooruitgang en beperkingen van de huidige therapieën voor hersentummoren van het type Glioblastoom te bespreken en om nieuwe benaderingen te presenteren die of in ontwikkeling zijn of waarvan de klinische studies zijn afgerond.
Glioblastoma Therapy: Past, Present and Future
- PMID: 38473776
- PMCID: PMC10931797
- DOI: 10.3390/ijms25052529
Abstract
Glioblastoma (GB) stands out as the most prevalent and lethal form of brain cancer. Although great efforts have been made by clinicians and researchers, no significant improvement in survival has been achieved since the Stupp protocol became the standard of care (SOC) in 2005. Despite multimodality treatments, recurrence is almost universal with survival rates under 2 years after diagnosis. Here, we discuss the recent progress in our understanding of GB pathophysiology, in particular, the importance of glioma stem cells (GSCs), the tumor microenvironment conditions, and epigenetic mechanisms involved in GB growth, aggressiveness and recurrence. The discussion on therapeutic strategies first covers the SOC treatment and targeted therapies that have been shown to interfere with different signaling pathways (pRB/CDK4/RB1/P16ink4, TP53/MDM2/P14arf, PI3k/Akt-PTEN, RAS/RAF/MEK, PARP) involved in GB tumorigenesis, pathophysiology, and treatment resistance acquisition. Below, we analyze several immunotherapeutic approaches (i.e., checkpoint inhibitors, vaccines, CAR-modified NK or T cells, oncolytic virotherapy) that have been used in an attempt to enhance the immune response against GB, and thereby avoid recidivism or increase survival of GB patients. Finally, we present treatment attempts made using nanotherapies (nanometric structures having active anti-GB agents such as antibodies, chemotherapeutic/anti-angiogenic drugs or sensitizers, radionuclides, and molecules that target GB cellular receptors or open the blood-brain barrier) and non-ionizing energies (laser interstitial thermal therapy, high/low intensity focused ultrasounds, photodynamic/sonodynamic therapies and electroporation). The aim of this review is to discuss the advances and limitations of the current therapies and to present novel approaches that are under development or following clinical trials.
Conflict of interest statement
Authors Elena Obrador, Paz Moreno-Murciano, María Oriol-Caballo, Rafael López-Blanch and José M. Estrela were employed by Scientia BioTech S.L. The author declares that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Similar articles
-
Combinatorial approaches to effective therapy in glioblastoma (GBM): Current status and what the future holds.Int Rev Immunol. 2022;41(6):582-605. doi: 10.1080/08830185.2022.2101647. Epub 2022 Aug 8.PMID: 35938932 Review.
-
Novel Therapies in Glioblastoma Treatment: Review of Glioblastoma; Current Treatment Options; and Novel Oncolytic Viral Therapies.Med Sci (Basel). 2023 Dec 23;12(1):1. doi: 10.3390/medsci12010001.PMID: 38249077 Free PMC article. Review.
-
Present and potential future adjuvant issues in high-grade astrocytic glioma treatment.Adv Tech Stand Neurosurg. 2009;34:3-35. doi: 10.1007/978-3-211-78741-0_1.PMID: 19368079 Review.
-
Oncolytic herpes simplex viruses for the treatment of glioma and targeting glioblastoma stem-like cells.Front Cell Infect Microbiol. 2023 May 31;13:1206111. doi: 10.3389/fcimb.2023.1206111. eCollection 2023.PMID: 37325516 Free PMC article. Review.
-
Oncolytic Viruses for Malignant Glioma: On the Verge of Success?Viruses. 2021 Jul 2;13(7):1294. doi: 10.3390/v13071294.PMID: 34372501 Free PMC article. Review.
Cited by
-
Advances in nano-delivery of phytochemicals for glioblastoma treatment.Discov Nano. 2024 Dec 24;19(1):216. doi: 10.1186/s11671-024-04172-9.PMID: 39718730 Free PMC article. Review.
-
Progress in Drug Delivery Systems Based on Nanoparticles for Improved Glioblastoma Therapy: Addressing Challenges and Investigating Opportunities.Cancers (Basel). 2025 Feb 19;17(4):701. doi: 10.3390/cancers17040701.PMID: 40002294 Free PMC article. Review.
-
Cell-Based Glioma Models for Anticancer Drug Screening: From Conventional Adherent Cell Cultures to Tumor-Specific Three-Dimensional Constructs.Cells. 2024 Dec 17;13(24):2085. doi: 10.3390/cells13242085.PMID: 39768176 Free PMC article. Review.
-
From cold to hot: mechanisms of hyperthermia in modulating tumor immunology for enhanced immunotherapy.Front Immunol. 2025 Feb 28;16:1487296. doi: 10.3389/fimmu.2025.1487296. eCollection 2025.PMID: 40092992 Free PMC article. Review.
-
Zonulin as Gatekeeper in Gut-Brain Axis: Dysregulation in Glioblastoma.Biomedicines. 2024 Jul 24;12(8):1649. doi: 10.3390/biomedicines12081649.PMID: 39200114 Free PMC article. Review.
References
- Louis D.N., Perry A., Wesseling P., Brat D.J., Cree I.A., Figarella-Branger D., Hawkins C., Ng H.K., Pfister S.M., Reifenberger G., et al. The 2021 WHO Classification of Tumors of the Central Nervous System: A Summary. Neuro-Oncology. 2021;23:1231–1251. doi: 10.1093/neuonc/noab106. - DOI - PMC - PubMed
Gerelateerde artikelen
- ESMO 2023: aanbevolen abstracten voor hersentumoren en neuro oncology door oncologen en wetenschappers
- ASCO 2023: aanbevolen abstracten gerelateerd aan de ziekte van Von Hippel-Lindau en disease–associated central nervous system (CNS) door wereldwijd bekende artsen en oncologen copy 1
- FDA - Food and Drug Administration geeft versnelde goedkeuring aan naxitamab plus Granulocyte Macrophage Colony Stimulating Factor (GM-CSF) voor hoog-risico neuroblastoom in het bot of het beenmerg
- Patienten met een hersentumor, type Glioblastoma en anaplastisch astrocytoma, met een EGFRvIII mutatie lijken baat te hebben met AMG 595, 47 procent bereikte stabiele ziekte
- Avastin - Bevacizumab toegevoegd aan chemo (Temozolomide - Temodal) faalt en geeft zelfs slechtere overall overleving op 1 jaar bij een behandeling van een hersentumor Glioblastoma
- Bestraling - radiotherapie bij hersentumoren: een aantal artikelen bij elkaar gezet.
- Biomoleculair profiel van laaggradige hersentumoren - astrocytomas, oligodendrogliomas en oligoastrocytomas - ontrafelt en bepaalde mutaties geven duidelijke prognose op overlevingskansen
- Biomoleculair profile onderzoek bij hersentumoren - glioblastoma multiforme maakt wezenlijk verschil in behandelingsresultaten blijkt uit twee studies copy 1
- Chemo bij hersentumoren: een overzicht van recente ontwikkelingen en artikelen, met name over Temodal - Temolzolomide
- Dendritische celtherapie vooral ook succesvol toepasbaar bij hersentumoren copy 1
- Erlotinib:- Tarceva werkt niet bij Glioblastoma Multiforme blijkt uit Europese gerandomiseerde fase II studie (ruim 100 deelnemers). Slechts 11 procent haalt 6 maandengrens van overleving.
- Erfelijke neuroblastoom (hersentumoren) blijkt te genezen te kunnen worden met ALK medicijn gebaseerd op de specifieke kiembaan mutatie ALK R1275Q mutatie copy 1
- Glioblastoom behandelingen: verleden, heden en toekomst. Overzichtstudie van hoe hersentumoren van het type Glioblastoma te behandelen. Van diagnose via DNA en genmutaties tot vormen van immuuntherapie
- Hersenmetastases: Hardnekkige misvattingen over behandelen van uitzaaiingen in het hoofd - de hersenen (chirurgie en/of radiotherapie) maken dat veel patiënten verkeerd worden behandeld en heeft grote gevolgen voor therapeutisch effect.
- Hersentumoren en dendritische celtherapie: een overzicht van recente ontwikkelingen en belangrijke studies copy 1
- Immuuntherapie bij hersentumoren met vaccins en virussen waaronder Newcastle Disease Virus. Een overzicht van recente ontwikkelingen. copy 1
- Kytogeen dieet naast chemo en bestraling bij hersentumoren wordt in fase II studie onderzocht in Erasmus medisch centrum copy 1
- Methadon: Wordt methadon (D,L-Methadone) aanvullend op chemo (temozolomide) en bestraling de genezende behandeling voor hersentumoren type glioblastoma?
- Monoterpene perillyl alcohol een natuurlijk middel verlengt overall overleving en ziektevrije tijd bij hersentumoren Glioblastoma hoog significant, vooral bij recidief van glioblastoma copy 1
- Neuroblastoom: 13-cis Retinoinezuur aanvullend gegeven naast en na chemo en myeloablatieve therapie (ABMT) verbetert de langjarige overall overleving van kinderen met een Neuroblastoom graad 3 en 4 tot 100 procent op 5 jaars meting
- Neuroblastomen: Lage dosis primaire chemotherapie plus stamceltransplantatie zorgt voor goede resultaten bij kinderen met lokaal inoperabele neuroblastoom, 27,2 % overleeft de 10 jaar
- NOVO TFF-100A is een niet toxische electroden aanpak van hersentumoren en geeft spectaculair betere resultaten dan chemo.
- ONC201 verdubbelt overleving van kinderen met diffuus middellijnglioom (DMG) of diffuus intrinsiek ponsglioom (DIPG) en ONC201 wordt nu onderzocht bij alle patienten met deze vormen van hersentumoren
- Operaties bij hersentumoren: hier een aantal artikelen over recente ontwikkelingen in chirurgie bij hersentumoren bij elkaar gezet.
- Ultra Sound: Geluidsgolven die bloed-hersenbarriëre openen geven langere overleving bij patiënten met hersentumoren van het type Glioblastoom
- PDT - Foto Dynamische Therapie voor hersentumoren: een overzicht van artikelen en recente ontwikkelingen. Scroll in linkerkolom voor artikelen. Update 27 maart 2010
- FET-PET scan met radio actief gelabelde amino zuren verbetert significant diagnose en uiteindelijk ook effect van behandelingen van hersentumoren in vergelijking met de MET scan
- Valgancyclovir toegevoegd aan temozolomide plus bestraling bij hersentumoren glioblastoma verbetert overall overleving met 11 maanden
- VORASIDENIB geeft verdubbeling van progressievrije ziekte (27 vs 11 maanden) bij patienten met een laaggradige hersentumor type oligodendroglioom of astrocytoom met een IDH1/2-mutatie in vergelijking met placebo
- Xerecept blijkt beter en geeft minder bijwerkingen dan dexamethason als aanvulling bij behandelingen van hersentumoren.
- Reguliere oncologie: een overzicht van recente ontwikkelingen en belangrijke studies in de reguliere oncologie




Plaats een reactie ...
Reageer op "Glioblastoom behandelingen: verleden, heden en toekomst. Overzichtstudie van hoe hersentumoren van het type Glioblastoma te behandelen. Van diagnose via DNA en genmutaties tot vormen van immuuntherapie"