Mocht u de informatie op onze website kanker-actueel.nl waarderen dan wilt u ons misschien ondersteunen met een donatie?
Ons rekeningnummer is: RABO 37.29.31.138 t.n.v. Stichting Gezondheid Actueel in Terneuzen.
Onze IBANcode is NL79 RABO 0372 9311 38
Als donateur kunt u ook korting krijgen bij verschillende bedrijven. En we hebben een ANBI status
18 november 2022: zie ook dit artikel: https://kanker-actueel.nl/dcvax-l-verbetert-overall-overleving-en-vermindert-kans-op-recidief-bij-patienten-met-nieuw-gediagnosticeerd-glioblastoom-en-recidiverend-glioblastoom-in-vergelijking-met-beste-standaardzorg.html
Zie ook in gerelateerde artikelen dit artikel:
1 september 2022: Arie stuurde me deze nieuwe peer reviewed analyse in PDF van de Fase III studie in vergelijking met 5 andere fase III studies als controlegroepen. Een verschil in 5-jaars overleving van 5,7 procent versus 13 procent is bevestigd. De remissie blijkt dus duurzaam en er ontstaat veel minder vaak een recidief dan bij standaard behandeling of bij andere vormen van immuuntherapie voor hersentumoren.
Klik op deze PDF voor alle details en vergelijkingen.
Voor wie zich wilt aanmelden voor het DC-VAX vaccin:
Het DC-VAX vaccin gaat op basis van compassionate use geproduceerd worden in Engeland en komt hiermee beschikbaar voor mensen met een hersentumor. De eerste patiënten zijn al geholpen. In een persbericht van Northwest Biotherapeutics staat vermeld hoe patiënten aanvraag kunnen doen.
Zij zijn de contactpersonen:
CONTACTS
Dave Innes
Tel: 804-513-4758
dinnes@nwbio.com
Les Goldman
Tel: 240-234-0059
lgoldman@nwbio.com
11 mei 2022: met dank aan Robert en Arie:
Gisteren zijn de resultaten uit de DCVax-L Phase 3 Trial (Glioblastoma Multiforma - GBM - hersentumor) gepresenteerd online. In de volgende PDF staan de resultaten beschreven. Deze zijn indrukwekkend te noemen, zie ook verderop in het artikel.
Voor de resultaten zie vooral de slides vanaf 22 t/m 26 in deze PDF: https://virtualtrials.org/dcvax/dcvax.pdf
Fantastische resultaten volgens de experts. Hier is de video van de presentatie. https://virtualtrials.org/dcvax.cfm
Mediane overall overleving (OS): 19.3 maanden vanaf moment van randomisatie (22.4 maanden vanaf operatie) vs. 16.5 maanden vanaf randomisatie in controlegroepen.mMGMT mediane overall overleving (OS): 30.2 maanden vanaf randomisatie (33 maanden vanaf operatie) vs 21.3 maanden vanaf radomisatie in controlegroepen
Overall overleving op 5-jaar: 13% vs 5.7%
Bij recidief van Glioblastoma multiforme (GBM): Mediane overall overleving (mOS): 19.3 maanden vanaf randomisatie (22.4 maanden vanaf operatie) vs. 16.5 maanden vanaf randomisatie in controlegroepen.
mMGMT Mediane overall overleving (mOS): 30.2 maanden vanaf radomisatie (33 maanden vanaf operatie) vs 21.3 maanden vanaf randomisatie in controlegroepen
Overall overleving op 5-jaar: 13% vs 5.7%
Mediane overall overleving (mOS): 13.2 maanden vs. 7.8 maanden vanaf recidief.
Overall overleving na recidief:
20.7% vs. 9.6% na 2 jaar na recidief.
11.1% vs. 5.1% na 30 maanden na recidief.
1 april 2022: Arie stuurde me deze presentatie van Linda Liau ( de P.I. van de NWBO GBM trial) over de resultaten van het DC-VAX vaccin.
De presentatie is via You Tube te bekijken: https://youtu.be/qMii2WVQEsE
Op 4.35 uur begint de echte presentatie met duidelijke foto's en grafieken als ondersteuning. Deze presentatie is 31 maart 2022 gedaan op de Universiteit van MIAMI. Het is een lange presentatie. De presentatie van Linda Liau duurt inclusief de vragen enz tot ongeveer 42.00 uur. Daarna begint een andere spreker.
Ik heb het zelf helemaal bekeken en zeker de moeite waard. Al staan sommige plaatjes wel heel lang in beeld terwijl zij heel klein in beeld haar presentatie doet. En het is ook wel voor een leek nogal ingewikkeld medisch Engels denk ik, al verduidelijken de Power Point beelden wel veel. Voor medisch specialisten is deze presentatie echt een prima aanvulling op wat we al weten. zie verderop in dit artikel
Voor de goedkeuring zijn er nieuwe eindpunten van de trial bepaald en geaccepteerd door de FDA, EMA, MHRA EN CANADA.
Ook de acceptatie van het vergelijken met een EXTERNE PLACEBOGROEP. Dit vanwege de ontdekte pseudo progressie en de zgn. cross overs die vanwege het resultaat van de DC-VAX onethisch zou zijn, en overgezet zijn naar de behandelingsgroep en zodoende de resultaten moeilijk leesbaar of niet significant zouden maken. Zowel de nieuwe eindpunten als de vergelijking met een externe placebo zijn nu tot in detail afgesteld op de resultaten van de NWBO Trial.
Zie verder hieronder over deze studies.
5 maart 2022: (met dank aan Arie die me hier op wees): Het DC-VAX vaccin gaat op basis van compassionate use geproduceerd worden in Engeland en komt hiermee beschikbaar voor mensen met een hersentumor. De eerste patiënten zijn al geholpen. In een persbericht van Northwest Biotherapeutics staat vermeld hoe patiënten aanvraag kunnen doen.
Zij zijn de contactpersonen:
CONTACTS
Dave Innes
Tel: 804-513-4758
dinnes@nwbio.com
Les Goldman
Tel: 240-234-0059
lgoldman@nwbio.com
Hier het vertaalde persbericht van Northwest Biotherapeutics dat als origineel is te lezen op deze sitepagina:
2 maart 2022: Britse productie voor GBM-vaccin is begonnen.
Northwest Biotherapeutics, gevestigd in Maryland, heeft aangekondigd dat de productie is begonnen van zijn eerste dendritische celkankervaccin voor de behandeling van een glioblastoompatiënt in zijn recent gelicentieerde Britse productiefaciliteit in Sawston.
Linda F. Powers, voorzitter en Chief Executive Officer van Northwest Biotherapeutics zei: "Bij Northwest Biotherapeutics zijn we verheugd dat onze geavanceerde productiefaciliteit nu operationeel is in Sawston, waar we in staat zijn om "Advanced Therapy Medicinal Products" (ATMP's) zoals onze gepersonaliseerde dendritische celvaccins voor hersenkankerpatiënten die nog leven gebruik maken.Dit is een ultramoderne faciliteit en is het hoogtepunt van jarenlange investeringen en ontwikkeling door teams van ingenieurs, technici, wetenschappers en regelgevende experts.
"ATMP's omvatten celtherapieën en gentherapieën - inclusief immuunceltherapieën voor kanker. De eerste immuunceltherapieën bereikten al patiënten of in klinische proeven bij verschillende vormen van kanker, en dergelijke therapieën kunnen ook nieuwe hoop bieden voor hersenkankerpatiënten.>>>>>>lees verder
9 juni 2021: Eindelijk is de fase III studie met het DC-vax vaccin voor hersentumoren gepubliceerd op ASCO 2021. Studieprotocol is dit: Study of a Drug [DCVax®-L] to Treat Newly Diagnosed GBM Brain Cancer (GBM)
Zie verder hieronder alles over deze studie.
3 september 2019: Met dank aan Arie die mij de nieuwe resultaten toestuurde van de fase III studie van dendritische celtherapie met het DC-VAX vaccin bij hersentumoren. Met weer betere en opvallende resultaten. En dan te bedenken dat Martin van de Bent ons idee van Utopie of Uitdaging niet zag zitten en bewust heeft tegen gewerkt. Waar vind je behandelingen voor glioblastomas waarvan patienten al langer dan 7 jaar leven. En niet 1 patient maar van de top 100 van de deelnemende patienten was de mediane overall overleving d.d. mei 2019 54 maanden met tientallen patienten die al langer dan 5 jaar leven zonder tekenen van een recidief. Voor alle duidelijkheid de mediane overall overleving voor hersentumoren met glioblastomas met standaard behandelingen van bestralen, operatie en chemo (temodal) is nog geen 12 maanden mediaan.
Klik op de link voor de nieuwste update van onderstaand beschreven studie Hier het laatste studierapport 28 mei 2019:
https://www.scribd.com/document/411229128/A-Dendritic-Cell-Cancer-Vaccine-Shines-Brighter-for-Glioblastoma-Patients is een vervolg op de vorige publicatie van mei 2018: First results on survival from a large Phase 3 clinical trial of an autologous dendritic cell vaccine in newly diagnosed glioblastoma
Zie ook verderop in dit artikel voor meer gegevens enz.
Hier studieprotocol en alle verdere gegevens. Studie staat nog steeds open in bepaalde ziekenhuizen
Interessant is ook de presentatie van Marnix Bosch op ASCO 2019 waarin hij uitlegt hoe de dendritische celtherapie met de DC-VAX vaccins werkzaam zijn.: klik op deze PDF voor de beelden erbij
Er zijn meerdere publicaties beschikbaar en er lopen meerdere trials met DC-Vax overigens, ook voor andere vormen van kanker:
Clinical Trials
DCVax®-L to Treat Newly Diagnosed GBM Brain Cancer (NCT00045968) - Phase III (Double Blind)
Expanded Access Protocol for GBM Patients with Already Manufactured DCVax®-L Who Have Screen-Failed Protocol 020221 (NCT02146066) (Expanded Access)
Safety and Efficacy Study of DCVax-Direct in Solid Tumors (NCT01882946) - Phase I/Phase II (Open Label)
UK Clinical Trials - Study of a Drug (DCVax®-L) to Treat Newly Diagnosed GBM Brain Cancer
EU Clinical Trials for DCVax-L - Phase III
Dendritic Cell Vaccine for Patients with Brain Tumors (NCT01204684) - Phase II - at UCLA - Randomized (Open Label) testing DCVaccine with Resiquimod and DC Vaccination with Adjuvant polyICLC
Dendritic Cell-Autologous Lung Tumor Vaccine (DCVax-L) and Nivolumab in Treating Patients with Recurrent Glioblastoma - Phase 2 (NCT03014804)
Announcement of DCVax-L and Anti-PD-1 Monoclonal Antibody (Pembrolizumab) for Patients with Liver Metastases of Primary Colorectal Carcinoma Phase 2 Trial - November 17, 2016 - University Medical Center (UMC) of the Johannes Gutenberg University of Mainz
Dendritic Cell Therapy for Brain Metastases From Breast or Lung Cancer (NCT0368765) - Phase 1 - Collaborator: Mayo Clinic
1 juni 2018: Lees ook dit artikel:
1 juni 2018: Met dank aan Robert. Bron: Journal of Translational Medicine201816:142 Received: 27 April 2018 Accepted: 7 May 2018 Published: 29 May 2018
Immuuntherapie met het vaccin DCVax-L (autologe dendritische celtherapie) verlengt overall overleving met vele maanden tot soms 7 jaar van patiënten met een hersentumor glioblastoma multiforme.
Eindelijk lijkt er een doorbraak te zijn in het behandelen van een hersentumor type glioblastoma multiforme. En bevestigt deze fase III crossover studie ons uitgangspunt uit Utopie of Uitdaging dat immuuntherapie bij een hersentumor van het type glioblastoma multiforme al moet beginnen bij de eerste diagnose. Want een behandeling met immuuntherapie met het vaccin DCVax-L (autologe dendritische celtherapie) na operatie en samen met standaard bestraling en chemo (temozolomide - Temodal) voor patienten met een nieuwe diagnose blijkt de mediane overall overleving minimaal te verdubbelen van historisch mediaan 16 maanden tot mediaan 34 maanden met uitschieters van patienten die al 7 jaar kankervrij zijn.
In het studierapport dat werd gepubliceerd in het Journal of Translational Medicine hebben onderzoekers de resultaten gepubliceerd van totaal 331 glioblastoma-patiënten (90 procent kreeg uiteindelijk het vaccin tot nu toe). Alle patiënten kregen in eerste instantie de standaardzorg voor een glioblastoma multiforme, namelijk chirurgie / operatie gevolgd door zowel radiotherapie als chemotherapie met temodal. 232 patiënten kregen naast de standaard behandeling regelmatig injecties met DCax-L, het experimentele vaccin. De andere 99 patiënten (placebogroep) kregen een placebo i.p.v. het vaccin. Echter, alle patiënten die een recidief kregen tijdens de studieperiode kregen ook het DCVax-L vaccin. Op moment van opmaken van deze tussenresultaten had 90 procent van alle patiënten het DCVax gehad. Daarom zijn de resultaten hoewel spectaculair goed met mediaan 23 maanden (met patienten uit crossover meegenomen mediane OS 34 maanden) tot uitschieters van 7 jaar, niet statistisch significant. Terwijl de mediane overall overleving voor de standaardzorg ca. 16 maanden is.
Uit het studierapport:
Study endpoints according to molecular genetic and clinical prognostic subgroups
|
Population |
n |
Median OS since surgery (months)a |
Survival at 1 yearb |
Survival at 2 yearsb |
Survival at 3 yearsb |
|---|---|---|---|---|---|
|
Overall |
331 |
23.1 (21.2, 25.4) |
89.3% (85.4, 92.2) |
46.2% (40.4, 51.8) |
25.4% (19.9, 31.3) |
|
MGMT methylated |
131 |
34.7 (27.0, 40.7) |
94.5% (88.8, 97.3) |
66.7% (57.5, 74.4) |
46.4% (35.8, 56.3) |
|
MGMT un-methylated |
162 |
19.8 (17.9, 21.7) |
86.4% (80.0, 90.8) |
32.1% (24.5, 9.9) |
11.0% (5.7, 18.2) |
|
Gross total resection |
209 |
25.4 (21.8, 28.2) |
91.8% (87.1, 94.8) |
51.2% (43.9, 58.1) |
29.9% (22.6, 37.5) |
|
Partial resection |
122 |
21.1 (19.1, 23.1) |
85.0% (77.2, 90.2) |
37.7% (28.6, 46.7) |
18.0% (10.5, 27.1) |
|
KPS at baseline ≥ 90 |
234 |
23.7 (21.8, 26.7) |
94.0% (90.0, 96.4) |
49.2% (42.3, 55.8) |
26.6% (19.9, 33.8) |
|
KPS at baseline < 90 |
97 |
19.8 (16.6, 23.9) |
77.8% (68.0, 84.9) |
38.8% (28.5, 49.0) |
22.1% (13.4, 32.2) |
|
ALC > 800 |
161 |
23.6 (21.7, 28.2) |
89.9% (84.0, 93.7) |
49.5% (41.1, 57.4) |
28.7% (20.6, 37.3) |
|
ALC ≤ 800 |
170 |
21.6 (19.9, 25.2) |
88.7% (82.8, 92.6) |
43.3% (35.4, 50.9) |
22.2% (15.0, 30.3) |
|
Age < 50 years |
82 |
26.2 (21.1, 31.5) |
92.5% (84.2, 96.6) |
51.7% (39.9, 62.3) |
28.0% (16.4, 40.8) |
|
Age ≥ 50 years |
249 |
22.4 (20.4, 24.1) |
88.2% (83.5, 91.7) |
44.4% (37.7, 50.8) |
24.6% (18.5, 31.2) |
Belangrijk om te vermelden is dat het verschil in overleving tussen patienten met wel en geen MGMT genen mutatie aanzienlijk was.
De MGMT gene promoter was gemuteerd bij 39.6% van de patiënten (n = 131) en niet gemuteerd bij 48.9% (n = 162), Voor 11.5% (n = 38) was er geen mutatie beschikbaar omdAt deze patienten eerder al waren gerekuteerd voor de MTGM meting standaard werd ingevoerd.
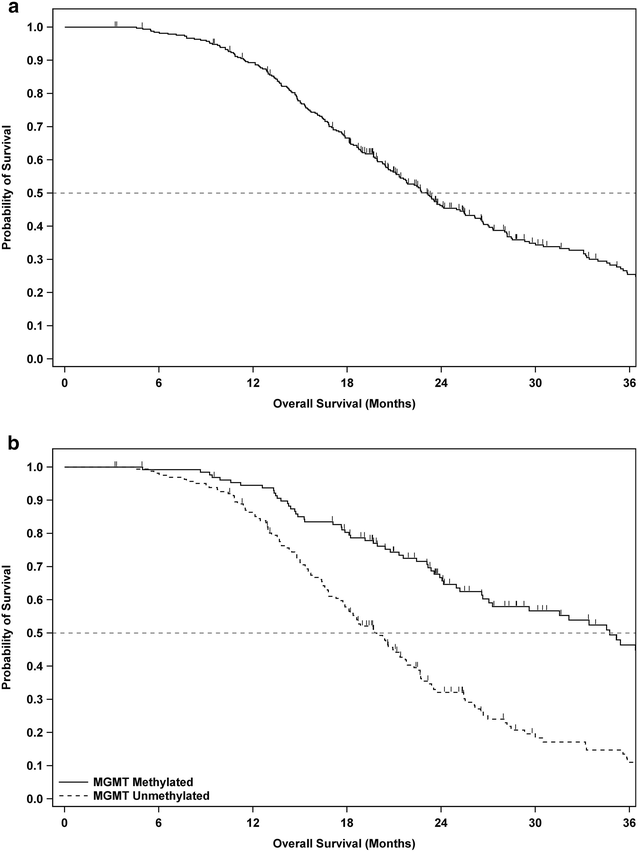
Al in 2011 kregen wij informatie over deze vorm van immuuntherapie (zie in gerelateerde artikelen) en nu 7 jaar later zijn de resultaten bekendgemaakt.
De studie is uitgevoerd op meer dan 80 locaties in 4 landen: de VS, Canada, Duitsland en het Verenigd Koninkrijk. De rekrutering van patiënten is in 2007 gestart en was om economische redenen tussen 2009 en 2011 onderbroken. De laatste patiënt werd ingeschreven in november 2015.
Conclusie: De resultaten toonden dus aan dat de behandeling veilig was, en patiënten die het vaccin kregen, leefden gemiddeld langer dan degenen die dat niet deden. Bijna 30 procent leefde gemiddeld 40,5 maanden na de operatie, en sommige overleven meer dan zeven jaar.
Het volledige studierapport: First results on survival from a large Phase 3 clinical trial of an autologous dendritic cell vaccine in newly diagnosed glioblastoma beschrijft to in detail hoe de studie is uitgevoerd.
Hier het abstract van de studie met referentielijst:
Addition of DCVax-L to standard therapy is feasible and safe in glioblastoma patients, and may extend survival.
Source:
https://doi.org/10.1186/s12967-018-1507-6
© The Author(s) 2018
Received: 27 April 2018
Accepted: 7 May 2018
Published: 29 May 2018
First results on survival from a large Phase 3 clinical trial of an autologous dendritic cell vaccine in newly diagnosed glioblastoma
- Linda M. LiauEmail author,
- Keyoumars Ashkan,
- David D. Tran,
- Jian L. Campian,
- John E. Trusheim,
- Charles S. Cobbs,
- Jason A. Heth,
- Michael Salacz,
- Sarah Taylor,
- Stacy D. D’Andre,
- Fabio M. Iwamoto,
- Edward J. Dropcho,
- Yaron A. Moshel,
- Kevin A. Walter,
- Clement P. Pillainayagam,
- Robert Aiken,
- Rekha Chaudhary,
- Samuel A. Goldlust,
- Daniela A. Bota,
- Paul Duic,
- Jai Grewal,
- Heinrich Elinzano,
- Steven A. Toms,
- Kevin O. Lillehei,
- Tom Mikkelsen,
- Tobias Walpert,
- Steven R. Abram,
- Andrew J. Brenner,
- Steven Brem,
- Matthew G. Ewend,
- Simon Khagi,
- Jana Portnow,
- Lyndon J. Kim,
- William G. Loudon,
- Reid C. Thompson,
- David E. Avigan,
- Karen L. Fink,
- Francois J. Geoffroy,
- Scott Lindhorst,
- Jose Lutzky,
- Andrew E. Sloan,
- Gabriele Schackert,
- Dietmar Krex,
- Hans-Jorg Meisel,
- Julian Wu,
- Raphael P. Davis,
- Christopher Duma,
- Arnold B. Etame,
- David Mathieu,
- Santosh Kesari,
- David Piccioni,
- Manfred Westphal,
- David S. Baskin,
- Pamela Z. New,
- Michel Lacroix,
- Sven-Axel May,
- Timothy J. Pluard,
- Victor Tse,
- Richard M. Green,
- John L. Villano,
- Michael Pearlman,
- Kevin Petrecca,
- Michael Schulder,
- Lynne P. Taylor,
- Anthony E. Maida,
- Robert M. Prins,
- Timothy F. Cloughesy,
- Paul Mulholland and
- Marnix L. BoschEmail authorView ORCID ID profile
Abstract
Background
Standard therapy for glioblastoma includes surgery, radiotherapy, and temozolomide. This Phase 3 trial evaluates the addition of an autologous tumor lysate-pulsed dendritic cell vaccine (DCVax®-L) to standard therapy for newly diagnosed glioblastoma.
Methods
After surgery and chemoradiotherapy, patients were randomized (2:1) to receive temozolomide plus DCVax-L (n = 232) or temozolomide and placebo (n = 99). Following recurrence, all patients were allowed to receive DCVax-L, without unblinding. The primary endpoint was progression free survival (PFS); the secondary endpoint was overall survival (OS).
Results
For the intent-to-treat (ITT) population (n = 331), median OS (mOS) was 23.1 months from surgery. Because of the cross-over trial design, nearly 90% of the ITT population received DCVax-L. For patients with methylated MGMT (n = 131), mOS was 34.7 months from surgery, with a 3-year survival of 46.4%. As of this analysis, 223 patients are ≥ 30 months past their surgery date; 67 of these (30.0%) have lived ≥ 30 months and have a Kaplan-Meier (KM)-derived mOS of 46.5 months. 182 patients are ≥ 36 months past surgery; 44 of these (24.2%) have lived ≥ 36 months and have a KM-derived mOS of 88.2 months. A population of extended survivors (n = 100) with mOS of 40.5 months, not explained by known prognostic factors, will be analyzed further. Only 2.1% of ITT patients (n = 7) had a grade 3 or 4 adverse event that was deemed at least possibly related to the vaccine. Overall adverse events with DCVax were comparable to standard therapy alone.
Conclusions
Addition of DCVax-L to standard therapy is feasible and safe in glioblastoma patients, and may extend survival.
Trial registration Funded by Northwest Biotherapeutics; Clinicaltrials.gov number: NCT00045968; https://clinicaltrials.gov/ct2/show/NCT00045968?term=NCT00045968&rank=1; initially registered 19 September 2002
References
- Ostrom QT, Gittleman H, Xu J, Kromer C, Wolinsky Y, Kruchko C, Barnholtz-Sloan JS. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2009–2013. Neuro-oncology. 2016;18(suppl_5):v1–75.View ArticlePubMedGoogle Scholar
- Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987–96.View ArticlePubMedGoogle Scholar
- Stupp R, Hegi ME, Mason WP, van den Bent MJ, Taphoorn MJ, Janzer RC, Ludwin SK, Allgeier A, Fisher B, Belanger K, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol. 2009;10(5):459–66.View ArticlePubMedGoogle Scholar
- Stupp R, Taillibert S, Kanner AA, Kesari S, Steinberg DM, Toms SA, Taylor LP, Lieberman F, Silvani A, Fink KL, et al. Maintenance therapy with tumor-treating fields plus temozolomide vs temozolomide alone for glioblastoma: a randomized clinical trial. JAMA. 2015;314(23):2535–43.View ArticlePubMedGoogle Scholar
- Wick W, Puduvalli VK, Chamberlain MC, van den Bent MJ, Carpentier AF, Cher LM, Mason W, Weller M, Hong S, Musib L, et al. Phase III study of enzastaurin compared with lomustine in the treatment of recurrent intracranial glioblastoma. J Clin Oncol. 2010;28(7):1168–74.View ArticlePubMedPubMed CentralGoogle Scholar
- Batchelor TT, Mulholland P, Neyns B, Nabors LB, Campone M, Wick A, Mason W, Mikkelsen T, Phuphanich S, Ashby LS, et al. Phase III randomized trial comparing the efficacy of cediranib as monotherapy, and in combination with lomustine, versus lomustine alone in patients with recurrent glioblastoma. J Clin Oncol. 2013;31(26):3212–8.View ArticlePubMedPubMed CentralGoogle Scholar
- Stupp R, Hegi ME, Gorlia T, Erridge SC, Perry J, Hong YK, Aldape KD, Lhermitte B, Pietsch T, Grujicic D, et al. Cilengitide combined with standard treatment for patients with newly diagnosed glioblastoma with methylated MGMT promoter (CENTRIC EORTC 26071-22072 study): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2014;15(10):1100–8.View ArticlePubMedGoogle Scholar
- Gilbert MR, Dignam JJ, Armstrong TS, Wefel JS, Blumenthal DT, Vogelbaum MA, Colman H, Chakravarti A, Pugh S, Won M, et al. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):699–708.View ArticlePubMedPubMed CentralGoogle Scholar
- Chinot OL, Wick W, Mason W, Henriksson R, Saran F, Nishikawa R, Carpentier AF, Hoang-Xuan K, Kavan P, Cernea D, et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):709–22.View ArticlePubMedGoogle Scholar
- Westphal M, Heese O, Steinbach JP, Schnell O, Schackert G, Mehdorn M, Schulz D, Simon M, Schlegel U, Senft C, et al. A randomised, open label phase III trial with nimotuzumab, an anti-epidermal growth factor receptor monoclonal antibody in the treatment of newly diagnosed adult glioblastoma. Eur J Cancer. 2015;51(4):522–32.View ArticlePubMedGoogle Scholar
- Palucka K, Banchereau J. Cancer immunotherapy via dendritic cells. Nat Rev Cancer. 2012;12(4):265–77.View ArticlePubMedPubMed CentralGoogle Scholar
- Hickey MJ, Malone CC, Erickson KL, Jadus MR, Prins RM, Liau LM, Kruse CA. Cellular and vaccine therapeutic approaches for gliomas. J Transl Med. 2010;8:100.View ArticlePubMedPubMed CentralGoogle Scholar
- Prins RM, Liau LM. Cellular immunity and immunotherapy of brain tumors. Front Biosci. 2004;9:3124–36.View ArticlePubMedGoogle Scholar
- Liau LM, Black KL, Prins RM, Sykes SN, DiPatre PL, Cloughesy TF, Becker DP, Bronstein JM. Treatment of intracranial gliomas with bone marrow-derived dendritic cells pulsed with tumor antigens. J Neurosurg. 1999;90(6):1115–24.View ArticlePubMedGoogle Scholar
- Prins RM, Craft N, Bruhn KW, Khan-Farooqi H, Koya RC, Stripecke R, Miller JF, Liau LM. The TLR-7 agonist, imiquimod, enhances dendritic cell survival and promotes tumor antigen-specific T cell priming: relation to central nervous system antitumor immunity. J Immunol. 2006;176(1):157–64.View ArticlePubMedGoogle Scholar
- Prins RM, Odesa SK, Liau LM. Immunotherapeutic targeting of shared melanoma-associated antigens in a murine glioma model. Cancer Res. 2003;63(23):8487–91.PubMedGoogle Scholar
- Liau LM, Prins RM, Kiertscher SM, Odesa SK, Kremen TJ, Giovannone AJ, Lin JW, Chute DJ, Mischel PS, Cloughesy TF, et al. Dendritic cell vaccination in glioblastoma patients induces systemic and intracranial T-cell responses modulated by the local central nervous system tumor microenvironment. Clin Cancer Res. 2005;11(15):5515–25.View ArticlePubMedGoogle Scholar
- Prins RM, Cloughesy TF, Liau LM. Cytomegalovirus immunity after vaccination with autologous glioblastoma lysate. N Engl J Med. 2008;359(5):539–41.View ArticlePubMedPubMed CentralGoogle Scholar
- Prins RM, Soto H, Konkankit V, Odesa SK, Eskin A, Yong WH, Nelson SF, Liau LM. Gene expression profile correlates with T-cell infiltration and relative survival in glioblastoma patients vaccinated with dendritic cell immunotherapy. Clin Cancer Res. 2011;17(6):1603–15.View ArticlePubMedGoogle Scholar
- Curran WJ Jr, Scott CB, Horton J, Nelson JS, Weinstein AS, Fischbach AJ, Chang CH, Rotman M, Asbell SO, Krisch RE, et al. Recursive partitioning analysis of prognostic factors in three Radiation Therapy Oncology Group malignant glioma trials. J Natl Cancer Inst. 1993;85(9):704–10.View ArticlePubMedGoogle Scholar
- Weller M, Butowski N, Tran DD, Recht LD, Lim M, Hirte H, Ashby L, Mechtler L, Goldlust SA, Iwamoto F, et al. Rindopepimut with temozolomide for patients with newly diagnosed, EGFRvIII-expressing glioblastoma (ACT IV): a randomised, double-blind, international phase 3 trial. Lancet Oncol. 2017;18:1378–85.View ArticleGoogle Scholar
- Hong S, Li H, Qian J, Yang J, Lu Y, Yi Q. Optimizing dendritic cell vaccine for immunotherapy in multiple myeloma: tumour lysates are more potent tumour antigens than idiotype protein to promote anti-tumour immunity. Clin Exp Immunol. 2012;170(2):167–77.View ArticlePubMedPubMed CentralGoogle Scholar
- Grossman SA, Ellsworth S, Campian J, Wild AT, Herman JM, Laheru D, Brock M, Balmanoukian A, Ye X. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 2015;13(10):1225–31.View ArticlePubMedPubMed CentralGoogle Scholar
- Stupp R, Taillibert S, Kanner A, Read W, Steinberg DM, Lhermitte B, Toms S, Idbaih A, Ahluwalia MS, Fink K, et al. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. JAMA. 2017;318(23):2306–16.View ArticlePubMedGoogle Scholar
- Friedman HS, Prados MD, Wen PY, Mikkelsen T, Schiff D, Abrey LE, Yung WK, Paleologos N, Nicholas MK, Jensen R, et al. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol. 2009;27(28):4733–40.View ArticlePubMedGoogle Scholar
- Harris SJ, Brown J, Lopez J, Yap TA. Immuno-oncology combinations: raising the tail of the survival curve. Cancer Biol Med. 2016;13(2):171–93.View ArticlePubMedPubMed CentralGoogle Scholar
- Parsons DW, Jones S, Zhang X, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Siu IM, Gallia GL, et al. An integrated genomic analysis of human glioblastoma multiforme. Science. 2008;321(5897):1807–12.View ArticlePubMedPubMed CentralGoogle Scholar
- Bosch ML, Prins RM. Prolonged survival for patients with recurrent glioblastoma multiforme who are treated with tumour lysate-pulsed autologous dendritic cells. Eur J Cancer. 2015;51(Supplement 1):S6–7.Google Scholar
- Larkin J, Chmielowski B, Lao CD, Hodi FS, Sharfman W, Weber J, Suijkerbuijk KPM, Azevedo S, Li H, Reshef D, et al. Neurologic serious adverse events associated with nivolumab plus ipilimumab or nivolumab alone in advanced melanoma, including a case series of encephalitis. Oncologist. 2017;22(6):709–18.View ArticlePubMedGoogle Scholar
- Maxwell R, Jackson CM, Lim M. Clinical trials investigating immune checkpoint blockade in glioblastoma. Curr Treat Options Oncol. 2017;18(8):51.View ArticlePubMedGoogle Scholar
Copyright
Gerelateerde artikelen
- Hiltonol - poly-YCLC versterkt effectiviteit van DCVax-L en zorgt voor nog betere resultaten op ziektevrije tijd en overall overleving bij hersentumoren type Glioblastoma Multiforme
- Immuuntherapie met het vaccin DCVax geeft uitstekende resultaten op overall overleving bij glioblastoma multiforme gegeven bij nieuwe diagnose na operatie blijkt uit fase 3 studie
- Vaccin DCVax(R)-Brain welke succesvol blijkt tegen hersentumoren - Glioblastoma nu officieel verkrijgbaar in Zwitserland. Adressen van ziekenhuizen waar trial loopt toegevoegd
- DCVax-L verbetert overall overleving en vermindert kans op recidief bij patiënten met nieuw gediagnosticeerd glioblastoom en recidiverend glioblastoom in vergelijking met beste standaardzorg



Plaats een reactie ...
1 Reactie op "Immuuntherapie met het vaccin DCVax geeft uitstekende resultaten op overall overleving bij glioblastoma multiforme gegeven bij nieuwe diagnose na operatie blijkt uit fase 3 studie"