Mocht u kanker-actueel de moeite waard vinden en ons willen ondersteunen om kanker-actueel online te houden dan kunt u ons machtigen voor een periodieke donatie via donaties: https://kanker-actueel.nl/NL/donaties.html of doneer al of niet anoniem op - rekeningnummer NL79 RABO 0372931138 t.n.v. Stichting Gezondheid Actueel in Amersfoort. Onze IBANcode is NL79 RABO 0372 9311 38
Elk bedrag is welkom. En we zijn een ANBI instelling dus uw donatie of gift is in principe aftrekbaar voor de belasting.
En als donateur kunt u ook korting krijgen bij verschillende bedrijven:
18 mei 2016: Bron: PLoS One. 2015 Mar 19;10(3):e0120064. doi: 10.1371/journal.pone.0120064. eCollection 2015
Antineoplastons A-10 en AS2-1 aanvullend op een HAI - hepatic arterial infusion (leverspoelingen via hoofdslagader) met 5-FU van leveruitzaaiingen vanuit darmkanker vooraf aan operatie geeft opmerkelijk langere levensduur en mediane overall overleving in vergelijking met HAI zonder antineoplastons.
Wanneer in Nederland of Belgie een patient met leveruitzaaiingen vanuit darmkanker vraagt om een behandeling van de leveruitzaaiingen dan krijgt deze meestal nul op het request. Er is altijd wel een reden waarom de oncologen zeggen dat dit geen zin heeft. In Azie kunnen patienten veel vaker een beroep doen op leverspoelingen (TACE) of chirurgie of bv. met andere ablatietechnieken als RFA bv. Wanneer die leverspoelingen en behandelingen vergezeld worden van niet-toxische aanpak dan hebben deze vaak ook veel succes. Zoals nu dus ook blijkt dat antineoplastons echt een duidelijke meerwaarde kunnen hebben.
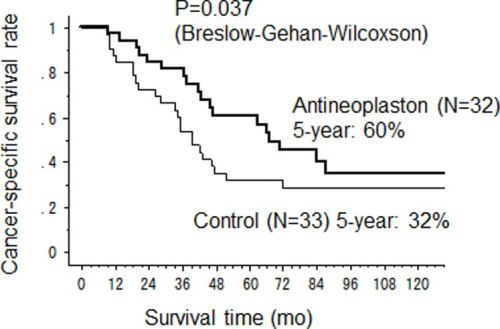
In onderstaande studie overleefde 60 procent de 5 jaar en degenen die de 5 jaar overleefden leefden meestal nog vele vele jaren, een groot aantal zelfs 10 jaar of langer. Zie onderstaande gegevens uit deze studie. Het is toch wel vreemd dat bv. in Medscape of in de ASCOpost je niets kunt lezen over deze studie terwijl een langere 5-jaars overleving van 28 procent - 28 maanden echt ongehoord goed is. Echt de moeite waard dus om uw arts toch eens dit te geven. Zie ook studielijst van niet-toxische middelen en behandelingen bij darmkanker.
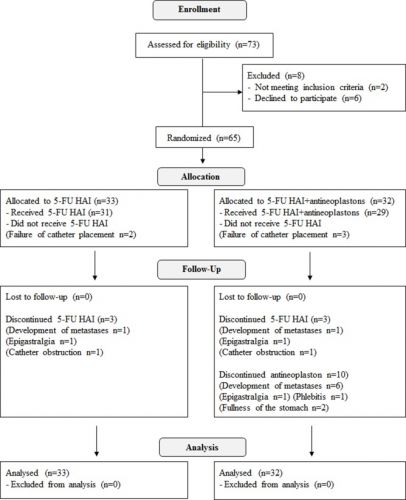
Studiegegevens antineoplaston studie bij in lever uitgezaaide darmkanker:
Mediane overall overleving was 67 maanden voor de HAI met 5-FU plus antineoplastongroep versus 39 maanden (95%CI 28-47) (p=0.037) voor alleen HAI met 5-FU en 5-jaars overleving was 60% versus 32%. Dit blijkt uit een gerandomiseerde studie bij totaal 65 patienten met in de lever uitgezaaide darmkanker die eerder een leveroperatie hebben ondergaan. De patienten werden geworven voor de studie in de periode 1998 tot 2004 in het Kurume University Hospital. Patienten werden gerandomiseerd ingedeeld in twee groepen.
1 groep kreeg systemisch antineoplastons toegediend (A10-I via infusie gevolgd door oraal in tabletvorm AS2-1) plus HAI met 5-FU (AN groep) of alleen HAI met 5-FU (controle groep). Selectiecriteria werden gebaseerd op uitzaaiingen en aanwezigheid of juist niet aanwezige extra leveruitzaaiingen op moment van de operatie. Primaire doel was kanker specifieke overleving (CSS); secondaire doelen waren recidiefvrije overleving (RFS), plaats, status en hoeveelheid van uitzaaiingen, palliatieve operaties (aantal) en toxiciteit - bijwerkingen.
Overleving:
Mediane follow-up periode was 43 maanden voor alle patienten en 120 maanden voor overlevenden.
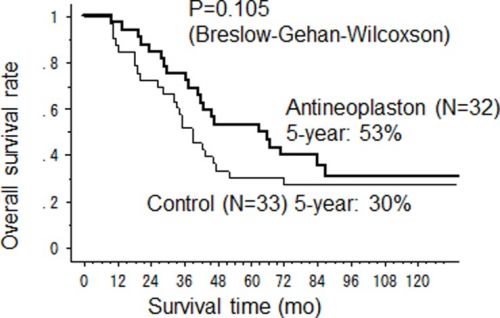
De mediane kankerspecifieke overleving (CSS) in de antineoplastongroep (AN groep) was significant langer dan die in de controlegroep (67 maanden versus 39 maanden respecctievelijk (95%CI 28–47) (p = 0.037). De 2-jaars, 5-jaars en 10-jaars CSS cijfers waren 84%, 60% en 35% in de antineoplastongroep en 73%, 32% en 29% in de controlegroep. De overall overleving (OS) was ook langer in de antineoplastongroep met een mediane OS tijd van 64.5 maanden (95%CI 38–92) versus 39 maanden (95%CI 28–47) voor de controlegroep, hoewel er geen statistisch significant verschil werd gevonden (p = 0.105).
Drie patienten overleden in de antineoplastongroep door andere oorzaken: aan een longontsteking, een acute myocardiaal infarct, aan een andere vorm van kanker en in de controlegroep overleed 1 patient aan een andere oorzaak. Echtere er was geen statistisch verschil tussen de antineoplastongroep en de controlegroep in recidiefvrije tijd 18 maanden voor de antineoplastongroep versus 16 maanden voor de controlegroep.
Post-operatieve recedieven en palliatieve operatie mogelijkheden:
Post-operatieve recidieven kwamen voor bij 23 patienten (72%) in de Antineoplastongroep en bij 26 patienten (78%) in de controle groep. De percentages van een recidief in de lever; 44%, in de longen; 28% en in andere organen; 31%, in de antineoplastongroep en in de controlegroep in de lever 55%, longen 42% en in andere organen 48%.
De recidiefcijfers in andere organen in de antineoplastongroep lijken lager te zijn dan in de controlegroep hoewel dit niet statistisch significant was. Interessant is echter dat in de controlegroep er bij meer patienten meer recidieven werden gezien in meerdere organen tegelijk dan in de antineoplastongroep. En de recidieven in de antineoplastongroep waren kleiner en kwamen vaker in aanmerking voor een pallietieve verwijdering middels een operatie of andere ablatietechniek: in de lever: 71% versus 44%; longen: 56% versus 21%; andere organen 40% versus 31%).
Het bijwerkingeprofiel van de antineoplastons, zoals gebruikt in de studie laat een relatief laag bijwerkingeprofiel zien, wat een ander voordeel is van deze aanpak. En bewijst ook dat antineoplastons veilig gebruikt kunnen worden naast andere chemotherapeutische behandelingen.
Conclusie:
We concluderen dat in deze studie antineoplastons hebben aangetoond een hoopgevend therapeutisch effectiviteit te geven op het voorkomen van een recidief na een operatie van leveruitzaaiingen ontstaan vanuit darmkanker met een mediane overall overleving van 67 maanden versus 39 maanden zonder antineoplastons.
Het toedienen van alleen oraal antineoplaston AS2–1 kan zeker ook een effectieve manier zijn om een recidief van uitgezaaide darmkanker te voorkomen of uit te stellen. Deze resultaten ondersteunen een grotere gerandomiseerde studie met antineoplastons A10 en AS2–1 in combinatie met HAI na een leveroperatie bij patienten met in de lever uitgezaaide darmkanker.
We hebben de publicatie van deze studie uitgestled omdat we simpelweg de 10-jaars overleving wilden beoordelen en we ook een corecte vertaling wilden van onze studieresutlaten in andere talen.
Deze studie is als eerste gepresenteerd al in 2010 op het 35th EMSO congres (Abstract No. 697). [34]
Het volledige studierapport: Randomized Phase II Study of 5-Fluorouracil Hepatic Arterial Infusion with or without Antineoplastons as an Adjuvant Therapy after Hepatectomy for Liver Metastases from Colorectal Cancer is gratis in te zien met duideliijke grafieken en uitstekende beschrijving van de werkwijze en resultaten.
Hier het abstract met die referentielijst:
Antineoplastons (A10 Injection and AS2-1) might be useful as adjunctive therapy in addition to HAI after hepatectomy in colorectal metastases to the liver.
Randomized phase II study of 5-fluorouracil hepatic arterial infusion with or without antineoplastons as an adjuvant therapy after hepatectomy for liver metastases from colorectal cancer.
Abstract
BACKGROUND:
Antineoplastons are naturally occurring peptides and amino acid derivatives found in human blood and urine. Antineoplaston A10 and AS2-1 reportedly control neoplastic growth and do not significantly inhibit normal cell growth. Antineoplastons contain 3-phenylacetylamino-2, 6-piperidinedione (A10), phenylacetylglutamine plus phenylacetylisoglutamine (A10-I), and phenylacetylglutamine plus phenylacetate (AS2-1). This open label, non- blinded randomized phase II study compared the efficacy of hepatic arterial infusion (HAI) with 5-fluorouracil,with or without antineoplastons as a postoperative therapy for colorectal metastasis to the liver.
METHODS:
Sixty-five patients with histologically confirmed metastatic colon adenocarcinoma in liver, who had undergone hepatectomy, and/or thermal ablation for liver metastases were enrolled between 1998- 2004 in Kurume University Hospital. Patients were randomly assigned to receive systemic antineoplastons (A10-I infusion followed by per-oral AS2-1) plus HAI (AN arm) or HAI alone (control arm) based on the number of metastases and presence/ absence of extra-hepatic metastasis at the time of surgery. Primary endpoint was cancer-specific survival (CSS); secondary endpoints were relapse-free survival (RFS), status and extent of recurrence, salvage surgery (rate) and toxicity.
FINDINGS:
Overall survival was not statistically improved (p=0.105) in the AN arm (n=32). RFS was not significant (p=0.343). Nevertheless, the CSS rate was significantly higher in the AN arm versus the control arm (n=33) with a median survival time 67 months (95%CI 43-not calculated) versus 39 months (95%CI 28-47) (p=0.037) and 5 year CSS rate 60% versus 32% respectively. Cancer recurred more often in a single organ than in multiple organs in the AN arm versus the control arm. The limited extent of recurrent tumours in the AN arm meant more patients remained eligible for salvage surgery. Major adverse effects of antineoplastons were fullness of the stomach and phlebitis. No serious toxicity, including bone marrow suppression, liver or renal dysfunction, were found in the AN arm.
INTERPRETATION:
Antineoplastons (A10 Injection and AS2-1) might be useful as adjunctive therapy in addition to HAI after hepatectomy in colorectal metastases to the liver.
TRIAL REGISTRATION INFORMATION:
ClinicalTrials.gov UMIN000012099.
- PMID:
- 25790229
- [PubMed - indexed for MEDLINE]
- PMCID:
- PMC4366171
-
References
1. Kanas GP, Taylor A, Primrose JN, Langeberg WJ, Kelsh MA, Mowat FS, et al. Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors. Clin Epidemiol. 2012;4: 283–301. doi: 10.2147/CLEP.S34285 [PMC free article] [PubMed]2. Tomlinson JS, Jarnajin WR, DeMatteo RP, Fong Y, Kornprat P, Gonen M, et al. Actual 10-year survival after resection of colorectal liver metastases defines cure. J Clin Oncol. 2007;25: 4575–4580. [PubMed]3. Weber SM, Jarnagin WR, DeMatteo RP, Blumgart LH, Fong Y. Survival after resection of multiple hepatic colorectal metastases. Ann Surg Oncol. 2000;7: 643–650. [PubMed]4. Portier G, Elias D, Bouche O, Rougier P, Bosset JF, Saric J, et al. Multicenter randomized trial of adjuvant fluorouracil and folinic acid compared with surgery alone after resection of colorectal liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol. 2006;24: 4976–4982. [PubMed]5. Mitry E, Fields AL, Bleiberg H, Labianca R, Portier G, Tu D, et al. Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer: a pooled analysis of two randomized trials. J Clin Oncol. 2008;26: 4906–4911. doi: 10.1200/JCO.2008.17.3781 [PubMed]6. Nordlinger B, Sorbye H, Glimelius B, Poston GJ, Schlag PM, Rougier P, et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet. 2008;371: 1007–1016. doi: 10.1016/S0140-6736(08)60455-9 [PMC free article] [PubMed]7. Mocellin S, Pilati P, Lise M, Nitti D. Meta-analysis of hepatic arterial infusion for unresectable liver metastases from colorectal cancer: the end of an era? J Clin Oncol. 2007;25: 5649–5654. [PubMed]8. Nelson R, Freels S. Hepatic artery adjuvant chemotherapy for patients having resection or ablation of colorectal cancer metastatic to the liver. Cochrane Database Syst Rev. 2006; October 18 (4).CD003770 [PubMed]9. Ensminger WD, Rosowsky A, Raso V, Levin DC, Glode M, Come S, et al. A clinical-pharmacological evaluation of hepatic arterial infusion of 5-fluro-2’-deoxiuridine and 5-flurouracil. Cancer Res. 1978;38: 3784–3792. [PubMed]10. Kemeny N, Huang Y, Cohen AM, Shi W, Conti JA, Brennan MF, et al. Hepatic arterial infusion of chemotherapy after resection of hepatic metastases from colorectal cancer. N Engl J Med. 1999;341: 2039–2048. [PubMed]11. Kanat O, Gewirtz A, Kemeny N. What is the potential role of hepatic arterial infusion chemotherapy in the current armamentarium against colorectal cancer. J Gastrointest Oncol. 2012;3: 130–138. doi: 10.3978/j.issn.2078-6891.2011.025 [PMC free article] [PubMed]12. Burzynski SR. Antineoplastons: biochemical defense against cancer. Physiol Chem Phys. 1976;8: 275–279. [PubMed]13. Tsuda H, Sugihara S, Nishida H, Hara H, Eriguchi N, Ishii K, et al. The inhibitory effect of the combination of antineoplaston A-10 injection with a small dose of cis-diamminedichloroplatinum on cell and tumor growth of human hepatocellular carcinoma. Jpn J Cancer Res. 1992;83: 527–531. [PubMed]14. Tsuda H, Iemura A, Sata M, Uchida M, Yamana K, Hara H. Inhibitory effect of antineoplaston A10 and AS2–1 on human hepatocellular carcinoma. Kurume Med J. 1996;43: 137–147. [PubMed]15. Nishida H, Yoshida H, Eriguchi N, Hoshino K, Kubota H, Hara H, et al. Inhibitory effect of orally-administered antineoplaston A10 on the growth curve of human breast cancer transplanted to athymic mice. J Jpn Soc Cancer Ther. 1991;26: 595–601.16. Tsuda H, Hara H, Eriguchi N, Nishida H, Yoshida H, Kumabe T, et al. Toxicological study on antineoplaston A-10 and AS2–1 in cancer patients. Kurume Med J. 1995;42: 241–249. [PubMed]17. Matono K, Ogata Y, Tsuda H, Araki Y, Shirouzu K. Effects of antineoplaston AS2–1 against post-operative lung metastasis in orthotopically implanted colon cancer in nude rat. Oncol Rep. 2005;13: 389–395. [PubMed]18. Rees M, Tekkies PP, Welsh FK, O’Rourke T, Jhon TG. Evaluation of long term survival after hepatic resection for metastatic colorectal cancer: a multifactorial model of 929 patients. Ann Surg. 2008;247: 125–135. [PubMed]19. Fong Y, Fortner J, Sun RL, Brennan MF, Blumgart LH. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg. 1999;230: 309–318. [PMC free article] [PubMed]20. Kemeny NE, Gonen M. Hepatic arterial infusion after liver resection. N Engl J Med. 2005;352: 734–735. [PubMed]21. Yeo W, Chung HC, Chan SL, Wang LZ, Lim R, Picus J, et al. Epigenetic therapy using belinostat for patients with unresectable hepatocellular carcinoma: a multicenter phase I/II study with biomarker and pharmacokinetic analysis of tumors from patients in the Mayo phase II Consortium and the Cancer Therapeutics Reseach Group. J Clin Oncol. 2012;27: 3361–3367. doi: 10.1200/JCO.2011.41.2395 [PMC free article] [PubMed]22. Wagner JM, Hackanson B, Lübbert M, Jung M. Histone deacetylase (HDAC) inhibitors in recent clinical trials for cancer therapy. Clinical Epigenetics. 2010;1: 117–136. [PMC free article] [PubMed]23. Qiu T, Zhou L, Zhu W, Wang T, Wang J, Shu Y, et al. Effects of treatment with histone deacetylase inhibitors in solid tumors: a review based on 30 clinical trials. Future Oncol. 2013;9: 255–269. doi: 10.2217/fon.12.173 [PubMed]24. Iannitti T, Palmieri B. Clinical and experimental application of sodium phenylbutyrate. Druds R D. 2011;11: 227–249. doi: 10.2165/11591280-000000000-00000 [PMC free article] [PubMed]25. Sung MW, Waxman S. Combination of cytotoxic-differentiation therapy with 5-fluorouracil and phenylbutyrate in patients with advanced colorectal cancer. Anticancer Res. 2007;27: 995–1001. [PubMed]26. Liau MC, Lee SS, Burzynski SR. Hypomethylation of nucleic acids: a key to the induction of terminal differentiation. Int J Exp Clin Chemother. 1989;2: 187–199.27. Samid D, Shack S, Myers CE. Selective growth arrest and phenotypic reversion of prostate cancer cells in vitro by non-toxic pharmacological concentrations of phenylacetate. J Clin Invest. 1993;91: 2288–2295. [PMC free article] [PubMed]28. Liu L, Shack S, Stetler-Stevenson WG, Hudgins WR, Samid D. Differentiation of cultured human melanoma cells induced by the aromatic fatty acids phenylacetate and phenylbutyrate. J Invest Dermatol. 1994;103: 335–340. [PubMed]29. Melchior SW, Brown LG, Figg WD, Quinn JE, Santucci RA, Brunner J, et al. Effects of phenylbutyrate on proliferation and apoptosis in human prostate cancer cells in vitro and in vivo. Int J Oncol. 1999;14: 501–508. [PubMed]30. Marks PA, Richon VM, Rifkind RA. Histone deacetylase inhibitors: inducers of differentiation or apoptosis of transformed cells. J Natl Cancer Inst.2000;92: 1210–1216. [PubMed]31. Harrison LE, Wojciechowicz DC, Brennan MF, Paty PB. Phenylacetate inhibits isoprenoid biosynthesis and suppresses growth of human pancreatic carcinoma. Surgery. 2000;124: 541–550. [PubMed]32. Ushijima M, Ogata Y, Tsuda H, Akagi Y, Matono K, Shirouzu K. Demethylation effect of the antineoplaston AS2–1 on genes in colon cancer cells. Oncol Rep. 2014;31: 19–26. doi: 10.3892/or.2013.2839 [PMC free article] [PubMed]33. Buckner JC, Malkin MG, Reed E, Cascino TL, Reid JM, Ames MM, et al. Phase II study of antineoplaston A10(NSC 648539) and AS2–1(NSC 620261) in patients with recurrent glioma. Mayo Clin Proc. 1999;74: 137–145. [PubMed]34. Ogata Y, Shirouzu K, Matono K, Ushijima M, Uchida S, Tsuda H. Randomized Phase II study of hepatic arterial infusion with or without antineoplastons as adjuvant therapy after hepatectomy for liver metastases from colorectal cancer. Ann Oncol. 2010;21: (Supplement 8) viii 221. [PMC free article] [PubMed]
Articles from PLoS ONE are provided here courtesy of Public Library of Science
Gerelateerde artikelen
- Studiepublicaties van niet-toxische middelen en behandelingen uit literatuurlijst van arts-bioloog drs. Engelbert Valstar, gerelateerd aan vormen van darmkanker
- Trainingsprogramma onder begeleiding na chemotherapie geeft statistisch significant langere kankervrije overleving bij darmkankerpatienten, blijkt uit gerandomiseerde fase III studie
- Veel vezelrijke voeding, vooral van granen, geeft minder darmkanker en betere overall overleving en betere specifieke overleving van operabele darmkanker in vergelijking met weinig vezelrijke voeding.
- Aanvullende niet toxische ondersteuning met bv. dieet, Chinese kruiden, acupunctuur, yoga enz. naast reguliere behandelingen bij darmkanker, vermindert kans op overlijden met 26 procent op 5 jaar.
- Moxibustion, een vorm van acupunctuur, voorkomt later diarree door chemokuur met irinotecan veroorzaakt bij patienten met gevorderde darmkanker. copy 1
- Antineoplastons A-10 en AS2-1 naast HAI - leverspoelingen met 5-FU na operatie van leveruitzaaiingen vanuit darmkanker zorgen voor opmerkelijk langere levensduur (plus 28 procent) en overall overleving op 5 jaar
- Antioxidanten - voedingsuppletie: calcium en meerdere soorten vitaminen hebben positief effect op een behandeling en ter voorkoming van recidief van darmkanker
- Aminozuren - BCAA, gegeven aan patiënten die een leveroperatie of leverperfusie - TACE - LITT - ondergaan, verkort significant de ligduur in het ziekenhuis en vermindert significant complicaties en versnelt herstel van leverfunctie
- Aspirine gebruik na diagnose van darmkanker geeft in vergelijking met geen aspirinegebruik een betere overleving met 12,5 procent op 3 jaars meting
- Calorie-arm plantaardig dieet dat vasten nabootst plus vitamine C samen gebruikt blijkt uitstekende niet-toxische behandeling voor KRAS gemuteerde kankercellen van spijsverteringskanker, waaronder darmkanker en alvleesklierkanker. copy 1
- Chinese kruiden: Injecties met Shenmai als aanvulling op chemokuren cisplatin en 5-FU bij gevorderde darmkanker geeft een significant betere 5 jaars ziektevrije tijd en significant betere kwaliteit van leven
- Curcumine toegevoegd aan FOLFOX chemotherapie voor darmkankerpatienten stadium IV geeft veel langere mediane overall overleving. 200 dagen versus 502 dagen
- Gezonde leefstijl aanvullend op standaard behandelingen geeft 51 procent minder kans op recidief en overlijden voor darmkankerpatienten
- Hyperthermie uitgevoerd naast chemo en bestraling bij rectumkanker geeft langere ziektevrije periode en meer overlevingen en bespaart bovendien significant vaker daarmee de anale functies.
- Maretak - Isorel gegeven vooraf en na operatie van kankerpatienten met vormen van spijsverteringskanker geeft significant betere mediane overleving en superieure kwaliteit van leven
- Melatonine aanmaak, melatonine tekort en melatonine suppletie spelen grote rol bij ons immuunsysteem en preventie en behandelen van spijsverteringskanker waaronder slokdarmkanker copy 1
- Newcastlevirus plus dendritische celtherapie geeft significant betere resultaten - langere overleving - bij patiënten met uitgezaaide darmkanker
- OK-432 - Sapylin naast chemo geeft minder recidieven, minder uitzaaiingen naar de lever bij een recidief en betere driejaars overleving 73.3% vs. 54.2% van operabele darmkanker stadium II en III copy 1
- Preventie van darmkanker en recidief van darmkanker voorkomen met niet toxische middelen en specifieke voedingstoffen is heel goed mogelijk en ook groeiend bewijs voor.
- Probiotica - melkzuurbacterien: informatie over wat is probiotica en effecten van probiotica bij o.a. darmkanker en ziekte van Crohn
- PSK - polysaccharide K - als aanvulling op de chemo - UFT en 5-FU - geeft na operatie bij darmkanker stadium II en III significant betere resultaten op 5-jaars overleving en definitieve overleving
- Voeding bij darmkanker, een overzicht van artikelen
- Zuurstof toegevoegd aan operatieve ingreep van darmkanker en rectumkanker vermindert de kans op wondinfecties met meer dan de helft.
- Complementair - aanvullende niet toxische middelen en behandelingen bij darmkanker: een overzicht van recente ontwikkelingen en belangrijke studies en artikelen



Plaats een reactie ...
Reageer op "Antineoplastons A-10 en AS2-1 naast HAI - leverspoelingen met 5-FU na operatie van leveruitzaaiingen vanuit darmkanker zorgen voor opmerkelijk langere levensduur (plus 28 procent) en overall overleving op 5 jaar"