Mocht u kanker-actueel de moeite waard vinden en ons willen ondersteunen om kanker-actueel online te houden dan kunt u ons machtigen voor een periodieke donatie via donaties: https://kanker-actueel.nl/NL/donaties.html of doneer al of niet anoniem op - rekeningnummer NL79 RABO 0372931138 t.n.v. Stichting Gezondheid Actueel in Amersfoort. Onze IBANcode is NL79 RABO 0372 9311 38
Elk bedrag is welkom. En we zijn een ANBI instelling dus uw donatie of gift is in principe aftrekbaar voor de belasting. En als donateur kunt u ook korting krijgen bij verschillende bedrijven:
4 februari 2016: Lees ook: Minister Schippers heeft nivolumab voor gevorderde longkanker in het basispakket opgenomen per 1 maart 2016.
1 december 2015: Aanvullend op onderstaande informatie is het misschien wel goed om dit studierapport eens te lezen of mee te nemen en te bespreken met uw behandelend arts: Advances in immunotherapy for treatment of lung cancer
Het abstract van deze studie staat onderaan artikel met ook mooie referentielijst
23 september 2015: Bron: ASCO Post
Met immuuntherapie verandert de aanpak van longkanker, maar is er nog steeds een plek voor gerichte therapie?
Twee deskundigen van de Emory Universiteit bespraken deze kwestie op de Debates and Didactics in Hematology and Oncology Conference recent gehouden in Sea Island, Georgia. Fadlo Khuri, MD, is recent benoemd als President of the American University of Beirut in Lebanon, en Suresh S. Ramalingam, MD, is Professor and Director of Medical Oncology aan de Emory Universiteit.
Ik heb hun bespreking zoals die in ASCO Post is gepubliceerd met hulp van google translation vrij vertaald in het Nederlands en soms extra informatie aan toegevoegd.
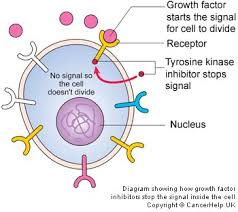
Foto: EGFR remmers
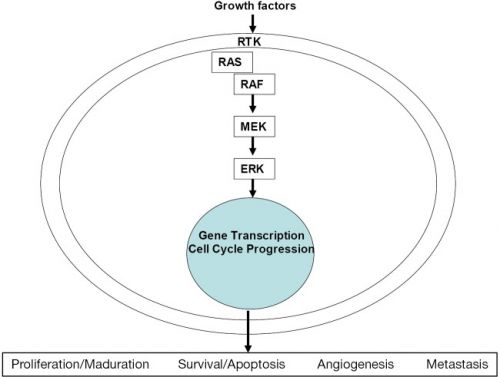
Doelgerichte behandeling op specifieke mutaties en receptoren expressie:
"In mijn ogen," zegt Dr. Khuri, "als een patiënt sterke DNA mutaties en een bepaalde receptoren expressie heeft dan is het logisch om in eerste instantie te kiezen voor een gerichte behandeling met EGFR remmers."
Longkanker vertoont ten minste drie opvallende mutaties (red: ALK, EGFR en BRAF), waarvan er tenminste bijna altijd één voorkomt bij minimaal 2/3 van de patiënten met adenocarcinomen. De helft of meer van deze patiënten zullen in eerste instantie dan ook goed reageren op gerichte medicijnen, met een duurzame controle van de ziekte," aldus Dr Khuri.
Deze gerichte behandelingen hebben een aantal voordelen: zo zijn de bekendste mutaties gemakkelijk vast te stellen, reageren patiënten meestal goed op de gerichte aanpak met doelgerichte medicijnen dus is er een grote mate van betrouwbaarheid en is er een gunstige kosten-batenverhouding en is er inmiddels veel kennis over de mechanismen van eventueel optredende resistentie.
De prognose van leven met niet-kleincellige longkanker (NSCLC) is dus drastisch veranderd met de ontdekking van mutaties in de epidermale groeifactor (EGFR). Het vermogen om dergelijke tumoren met tyrosine kinase remmers onder controle te houden met het behandelen van patiënten met een EGFR muitatie / expressie is inmiddels algemeen geaccepteerd en bekend. EGFR-remmers zijn en blijven inmiddels de eerstelijns standaard behandeling, zegt dr. Khuri.
Het ontstaan van resistentie is echter de achilleshiel van een doelgerichte behandeling met EGFR remmers. Maar er zijn inmiddels wel geneesmiddelen in ontwikkeling die de aanpak van dat probleem lijken op te lossen, vooral door het aanpakken van de specifieke T790M mutatie. Ongeveer bij de helft van de longkankerpatiënten bij wie de ziekte progressie vertoont treedt deze mutatie op.
"We hebben nu een indrukwekkend arsenaal aan gegevens waaruit blijkt dat we deze mutatie begrijpen. We begrijpen de biologie ervan en de prognose en we hebben inmiddels behandelingen / medicijnen die zich richten op juist deze T790M mutatie", zegt dr. Khuri.
Patiënten met een T790M mutatie zullen bijna altijd goed reageren op de derde generatie EGFR remmer met de naam AZD9291. In een onderzoek van 138 mutatie-positieve patiënten, bedroeg de ziektecontrole 95% (Zie referentie: 1. JANNE PA, Yang JC, Kim DW, et al: AZD9291 in EGFR remmer-resistent niet-kleincellige longkanker. N Engl J Med 372: 1689-1699, 2015.)
Soortgelijke middelen zijn in ontwikkeling, waaronder rociletinib (CO-1686), waarin ook een ziektebestrijding percentage van 93% werd aangetoond en produceerde positieve responses (aanslaan) bij bijna 60% van de patiënten met een T790M mutatie. (zie referentie 2. Sequist LV, Soria JC, Goldman JW, et al: Rociletinib in EGFR gemuteerde niet- kleincellige longkanker. N Engl J Med 372: 1700-1709, 2015.)
Het ALK fusie-gen vertegenwoordigt het andere "succesverhaal" van een doelgerichte behandeling. En de aanpak daarvan toont een opvallende effectiviteit (een verdubbeling van de progressievrije overleving) bij de 5% van de patiënten met niet-klein-cellige longkanker - NSCLC die deze ALK mutatie hebben. De ALK-remmer crizotinib (Xalkori) kreeg snel officiële toestemming van de FDA o.a.. (zie referentie 3. Shaw AT, Kim DW, Nakagawa K, et al: crizotinib versus chemotherapie in geavanceerde ALK-positieve longkanker. N Engl J Med 368: 2385-2394, 2013.)
Optredende resistentie tegen crizotinib wordt inmiddels ook onderzocht en men leert meer en meer over de mechanismen van resistentie tegen ALK remmers, die wel verschillen van die mechanismes die zijn waargenomen bij resistentie met EGFR-remmers. Derde generatie ALK inhibitoren zijn in ontwikkeling, waaronder ceritinib (Zykadia) en alectinib, welke effectief zijn bij meer dan 50% van eerder met crizotinib behandelde patiënten. De tweeledige ALK / EGFR-remmer AP26113 is ook actief bij patiënten met secundaire resistentie tegen ALK, merkt dr. Khuri op. (zie ook dit artikel: https://kanker-actueel.nl/NL/crizotinib-is-superieur-aan-pemetrexed-alimta-of-chemo-docetaxel-bij-niet-klein-cellige-longkanker-met-alk-positieve-genmutatie.html
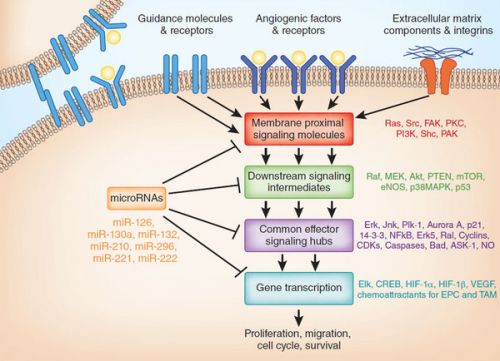
Foto: ALK werkingsmechanisme
BRAF, de derde bekende mutatie waarvoor een gerichte aanpak bestaat wordt bij longkankerpatiënten geïdentificeerd bij 1% tot 2% van de patiënten. Monotherapie met dabrafenib (Tafinlar) leverde een ziekte controle op van 56% na 12 weken en een mediane duur van de respons van 11,8 maanden bij eerder behandelde longkankerpatiënten. (zie referentie 4. Planchard D, Kim TM, Mazières J, et al: Dabrafenib in patients with BRAF V600E-mutant advanced non-small cell lung cancer: A multicenter, open-label phase II trial (BRF113928). 2014 ESMO Congress. Abstract LBA38_PR. Presented September 29, 2014.) (Zie ook: BRAF remmers bij longkanker: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4367599/)
De aanpak zou nog effectiever kunnen zijn in combinatie met trametinib (Mekinist), zegt Dr. Khuri.
De plaats van immuuntherapie:
Aangezien een doelgerichte therapie beperkt is tot patiënten met bekende mutaties en receptorenexpressie, is er ook een plaats voor immuuntherapie, vooral als tweede lijns behandeling, zegt Dr Khuri. "Als je weet dat je een bepaalde mutatie hebt, ga je aan de slag met een daarop gerichte therapie. Maar zonder een bekende mutatie, in de tweede lijns aanpak, ga je behandelen met nivolumab , welke superieur is aan chemo met docetaxel, "aldus dr. Khuri.
"Het geeft geen enkele discussie dat immuuntherapie het interessantste gebied binnen de oncologie is. Vooral als immuuntherapie wordt gecombineerd met korte chemokuren en/of bestraling. Met die combinatie zien we spectaculaire resultaten, ' erkent ook dr. Khuri.
Echter, Dr Khuri wees er ook op dat de voordelen ook kunnen worden vergezeld door meer bijwerkingen, meer toxiciteit (vooral met combinaties) dan wordt gezien met een gerichte behandeling. "Een van de meest evidente "toxiciteit" is te zien op de bankrekening!" Voegde hij eraan toe.
Voor een mediane progressievrije overleving van 6,9 maanden, kost nivolumab als monotherapie meer dan $ 100.000 per patiënt. Voor een mediane progressievrije overleving van 11,4 maanden, zijn de geschatte kosten $ 300.000, volgens sommige berekeningen.
"Naar mijn mening is dit waarschijnlijk meer dan de markt kan verdragen," is Dr Khuri's commentaar. "In combinatie met een 20% bijbetaling door patiënten zal dit onhoudbaar zijn."
Dr. Ramalingam wijst erop dat hoe goed een gerichte behandeling ook is, deze aanpak nog nooit een patiënt met longkanker heeft genezen. "Immuuntherapie heeft een veel sterkere invloed op longkanker dan welke gerichte behandeling dan ook, tot nu toe heeft gehad," zegt hij. "Immuuntherapie verbetert de overall overleving veel beter en kan zelfs genezend zijn en dit kan niet gezegd worden van de medicijnen die gebruikt worden in een gerichte behandeling." Aldus dr. Ramalingam
Bovendien voegde hij eraan toe, kan immuuntherapie worden toegepast op alle andere patiënten, dit in tegenstelling tot een gerichte behandeling. Het klinische effect is niet alleen voorbehouden aan personen die een weinig tot geen roken geschiedenis hebben (dat wil zeggen, niet de gemiddelde patiënt). Immuuntherapie richt zich op de "huis-, tuin- en keuken longkankerpatiënt," dat wil zeggen door roken ontstane tumoren met veel verschillende mutaties, aldus dr. Ramalingam.
Dr. Ramalingam herinnert de luisteraars eraan dat, "hoewel 65% van de longkankerpatiënten een afwijkende mutatie hebben, maar bij 25% van hen zal dat zijn in KRAS, welke mutatie nog steeds smeekt om een behandelingsoptie." Gerichte behandelingen worden daarom gebruikt bij een kleine percentage van onze longkankerpatiënten." Zegt dr. Ramalingam
Extra belemmeringen voor het gebruik van gerichte therapieën zijn het ontstaan van resistentie, waarvoor de huidige opties nog zijn beperkt, en hun falen om eerder in het ziekteverloop effectief te zijn. Echter, gerichte behandelingen hebben als voordeel over immuuntherapie dat ze vaker aanslaan - betere respons, erkent hij, maar voegt daaraan toe dat wanneer patiënten goed reageren op immuuntherapie, het effect duurzaam kan zijn.
Foto: cancer vaccines
Overleving met immuuntherapie:
"We hebben nu ook de algehele overleving gegevens die aantonen dat immuuntherapie met Nivolumab superieur blijkt te zijn," zei Dr Ramalingam.
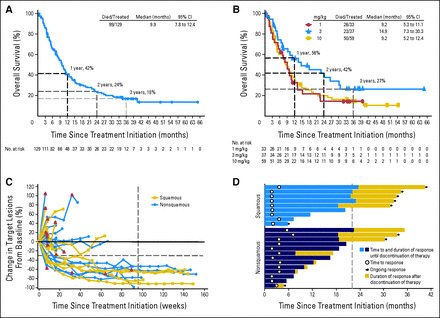
In een fase I studie van nivolumab in refractaire niet-kleincellige longkanker - NSCLC, de 2-jaars overleving was 24% en na 3 jaar blijkt 18% van zwaar voorbehandelde patiënten vrij van progressie te blijven, merkte hij op. "Om 3 jaar later nog in leven te zijn is een heel prettig vooruitzicht voor patienten waarvoor geen opties meer waren," voegt Dr. Ramalingam eraan toe.
In de fase III CheckMate 017 studie bij eerder behandelde longkankerpatiënten met een plaveiselcelcarcinoom, verbeterde nivolumab aanzienlijk beter de totale overleving dan docetaxel in de tweedelijns setting. (zie referentie: 6. Spigel DR, Reckamp KL, Rizvi NA, et al: A phase III study (CheckMate 017) of nivolumab vs docetaxel in previously treated advanced or metastatic squamous cell non-small cell lung cancer. 2015 ASCO Annual Meeting. Abstract 8009. Presented May 29, 2015.
"De hazard ratio van 0,59 steekt gunstig af bij de hazard ratio met gerichte behandelingen versus chemotherapie in de eerstelijns aanpak en dit is de tweede lijns,"voegde hij eraan toe. "First-line data zal vrijkomen binnen een jaar of zo, en als dit een teken is van wat komen gaat, dan gaan we een interessante tijd tegemoet."
De mogelijkheid van overleving op lange termijn wordt verder geïllustreerd door een studie onder leiding van Dr Ramalingam van nivolumab bij patiënten met plaveiselcelcarcinoom carcinoma die een recidief kregen. (Zie referentie 7. Rizvi NA, Mazières J, Planchard D, et al: Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): A phase 2, single-arm trial. Lancet Oncol 16:257-265, 2015.)
Hoewel de respons slechts 14% was, bereikten bijna alle patiënten waarbij de aanpak aansloeg een duurzame respons. als gevolg van nivolumab.
"Dat zegt ons veel over de kracht van immunotherapie", zegt hij. "Met gerichte therapie, de mediane progressievrije overleving is 10 tot 13 maanden. Bij deze patiënten, hebben we de mediane progressievrije tijd nog niet bereikt. "
Ook is er activiteit in niet plaveiselcarcinomen aangetoond en bewijst dat de anti-PD-1 (geprogrammeerde celdood) antilichamen geen "one-trick pony" zijn, vervolgde hij. Hoewel het een iets lagere hazard ratio opleverde (0,73), gaf nivolumab een betere overleving dan docetaxel als tweede lijns behandeling van patiënten met niet plaveiselcarcinomen in de fase III CheckMate 057 studie. (zie referentie 8. Paz-Ares, L, Horn L, Borghaei H, et al: Phase III, randomized trial (CheckMate 057) of nivolumab versus docetaxel in advanced non-squamous cell non-small cell lung cancer. 2015 ASCO Annual Meeting. Abstract LBA109. Presented May 29, 2015.)
"Deze twee studies tonen aan dat immuuntherapie met nivolumab gerichte therapie in de tweede lijns overklast," aldus dr. Ramalingam.
Zie ook hier een video van hoe nivolumab precies werkt: http://meetinglibrary.asco.org/content/111777?media=vm
Na Nivolumab:
Sterke resultaten zijn ook in aantocht voor anti-PD-1 / PD-L1 (de ligand) medicijnen anders dan nivolumab. In de fase II POPLAR studie, verbetert atezolizumab aanzienlijk de totale overleving versus docetaxel bij patiënten met een sterke PD-L1 expressie; De respons was 38%, en de mediane totale overleving was nog niet bereikt.( zie referentie 9. Spira AI, Park K, Mazières J, et al: Efficacy, safety and predictive biomarker results from a randomized phase II study comparing MPDL3280A vs docetaxel in 2L/3L NSCLC (POPLAR). 2015 ASCO Annual Meeting. Abstract 8010. Presented May 29, 2015.)
"Hoewel dergelijke bevindingen suggereren dat PD-L1 expressie kan helpen in de selectie van patiënten, zijn deze medicijen ook werkzaam bij patiënten zonder duidelijke PD-L1 expressie en blijken ook effectief bij PD-L1-negatieve patiënten. Hun resultaten zijn minstens zo goed als bij chemotherapie en we moeten dit in gedachten houden als we praten over een voorselectie van patiënten voor deze aanpak." Aldus Dr Ramalingam
Indrukwekkende resultaten werden ook bereikt bij PD-L1-positieve patiënten die pembrolizumab (Keytruda) kregen in de KEYNOTE-001.10 studie. In de recent bijgewerkte resultaten blijkt hoge expressie (≥ 50% vlekken) een een respons te geven van 52%, een mediane progressievrije overleving van 12,5 maanden en een mediane overleving die nog niet was bereikt.
De anti-PD-1 / PD-L1 middelen kunnen nog effectiever zijn in combinatie met andere medicijnen. In de vroege fase studies, heeft pembrolizumab plus chemotherapie een ziekte controle van 100%, met een relatief goede tolerantie, voegde hij eraan toe. (zie referentie 10. Garon EB, Rizvi NA, Hui R et al: Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 372:2018-2028, 2015.)
Tot slot, Dr. Ramalingam houdt vol in deze discussie dat immunotherapie de beste kans op de lange termijn biedt om te overleven met vergevorderde longkanker en een middel dat de biologie / ontwikkeling van deze ziekte kan veranderen.
Disclosure: Dr. Khuri heeft geen potentiële belangenconflicten gemeld. Dr. Ramalingam heeft gewerkt voor de adviesraden en heeft honoraria ontvangen van AstraZeneca, Bristol-Myers Squibb, Merck en Genentech.
References
1. Jänne PA, Yang JC, Kim DW, et al: AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer. N Engl J Med 372:1689-1699, 2015.
2. Sequist LV, Soria JC, Goldman JW, et al: Rociletinib in EGFR-mutated non-small cell lung cancer. N Engl J Med 372:1700-1709, 2015.
3. Shaw AT, Kim DW, Nakagawa K, et al: Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 368:2385-2394, 2013.
4. Planchard D, Kim TM, Mazières J, et al: Dabrafenib in patients with BRAF V600E-mutant advanced non-small cell lung cancer: A multicenter, open-label phase II trial (BRF113928). 2014 ESMO Congress. Abstract LBA38_PR. Presented September 29, 2014.
5. Brahmer J, Horn L, Antonia S: Nivolumab in patients with non-small cell lung cancer: Overall survival and long-term safety in phase 1 trial. 2013 IASLC 15th World Conference on Lung Cancer. Abstract MO 18.03.
6. Spigel DR, Reckamp KL, Rizvi NA, et al: A phase III study (CheckMate 017) of nivolumab vs docetaxel in previously treated advanced or metastatic squamous cell non-small cell lung cancer. 2015 ASCO Annual Meeting. Abstract 8009. Presented May 29, 2015.
7. Rizvi NA, Mazières J, Planchard D, et al: Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): A phase 2, single-arm trial. Lancet Oncol 16:257-265, 2015.
8. Paz-Ares, L, Horn L, Borghaei H, et al: Phase III, randomized trial (CheckMate 057) of nivolumab versus docetaxel in advanced non-squamous cell non-small cell lung cancer. 2015 ASCO Annual Meeting. Abstract LBA109. Presented May 29, 2015.
9. Spira AI, Park K, Mazières J, et al: Efficacy, safety and predictive biomarker results from a randomized phase II study comparing MPDL3280A vs docetaxel in 2L/3L NSCLC (POPLAR). 2015 ASCO Annual Meeting. Abstract 8010. Presented May 29, 2015.
10. Garon EB, Rizvi NA, Hui R et al: Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 372:2018-2028, 2015.
Bovenstaande is een vrije vertaling van het artikel uit de ASCO Post: Positioning Targeted and Immunotherapy-Based Approaches in Lung Cancer
Clinical trials with anti PD-1/PD-L1 antibodies in NSCLC have demonstrated very good tolerability and activity, with response rates around 20% and a median duration of response of 18 months.
Advances in immunotherapy for treatment of lung cancer
Abstract
Different approaches for treating lung cancer have been developed over time, including chemotherapy, radiotherapy and targeted therapies against activating mutations. Lately, better understanding of the role of the immunological system in tumor control has opened multiple doors to implement different strategies to enhance immune response against cancer cells. It is known that tumor cells elude immune response by several mechanisms. The development of monoclonal antibodies against the checkpoint inhibitor programmed cell death protein 1 (PD-1) and its ligand (PD-L1), on T cells, has led to high activity in cancer patients with long lasting responses. Nivolumab, an anti PD-1 inhibitor, has been recently approved for the treatment of squamous cell lung cancer patients, given the survival advantage demonstrated in a phase III trial. Pembrolizumab, another anti PD-1 antibody, has received FDA breakthrough therapy designation for treatment of non-small cell lung cancer (NSCLC), supported by data from a phase I trial. Clinical trials with anti PD-1/PD-L1 antibodies in NSCLC have demonstrated very good tolerability and activity, with response rates around 20% and a median duration of response of 18 months.
References
Gerelateerde artikelen
- Poeptransplantatie - Fecale Microbiota Transplantatie (FMT) vergroot effectiviteit van immuuntherapie bij niet-kleincellige longkanker en melanomen
- Immuuntherapie plus chemotherapie in de ochtend geeft veel betere overleving (plus 13 maanden) in vergelijking met toediening in de middag bij patiënten met niet-kleincellige longkanker
- CAN-2409, een virale vorm van immuuntherapie verlengt mediane overleving van patiënten met niet-operable stadium III/IV niet-kleincellig longkanker na falen immuuntherapie met anti-PD medicijnen
- Pumitamig, een bispecifieke antilichaam, naast chemotherapie geeft uitstekende resultaten bij patienten met gevorderde kleincellige longkanker
- Atezolizumab geeft bij patienten met longkanker bij wie dubbele platina chemotherapie niet mogelijk was verdubbeling van overall overleving (24 vs 12 procent) in vergelijking met enkelvoudige chemokuur
- Immuuntherapie met pembrolizumab vooraf aan operatie bij niet kleincellige longkanker stadium II en III gevolgd door onderhoudsdosis pembrolizumab verbetert ziektevrije tijd in vergelijking met placebo op 2 jaars meting
- Immuuntherapie met 2 kuren nivolumab - OPDIVO vooraf aan operatie bij operabele longkanker bereikt op 5-jaars meting 80 procent overall overleving en 60 procent recidiefvrije overleving.
- Immuuntherapie met anti-PD medicijnen als eerstelijns geeft zelfde of nog betere resultaten dan gecombineerd met chemotherapie op platinabasis bij niet-kleincellige longkanker
- Imfinzi (durvalumab) een immuuntherapeutisch medicijn is in lagere dosis en minder frequent gegeven net zo effectief bij longkanker stadium III en gevorderde blaaskanker. FDA geeft hieraan goedkeuring.
- Nivolumab naast carboplatine en etoposide (CE) geeft als eerstelijnsbehandeling voor gevorderde kleincellige longkanker betere resultaten in overall overleving vergelijking met alleen chemo
- Pembrolizumab geeft betere resultaten dan docetaxel bij patiënten met al eerder behandelde niet-kleincellige longkanker op 3-jaars meting na 2 jaar pembrolizumab. 35 vs 13 procent overall overleving.
- Combinatiebehandeling van Bemcentinib en Pembrolizumab geeft alsnog uitstekende resultaten (40 procent PR of CR) patienten met niet-kleincellige longkanker waar chemo faalde. copy 1
- immuuntherapie met pembrolizumab na lokale operatie of stereotactische bestraling van uitgezaaide niet-kleincellige longkanker geeft veel betere overall overleving dan statistisch cijfers
- immuuntherapie met anti-PD medicijn nivolumab bij uitgezaaide longkanker stadium IV geeft nagenoeg gelijke overall overleving maar met veel minder bijwerkingen dan chemotherapie
- Immuuntherapie met alleen Pembrolizumab geeft betere overall overleving in vergelijking met chemo voor onbehandelde patienten met uitgezaaide niet-kleincellige longkanker. Ook bij patienten met weinig PD-L1–Expressie
- Immuuntherapie met de combinatie van pembrolizumab plus Entinostat, een HDAC-remmer, geeft alsnog bij patienten met klein-cellige longkanker een respons die eerder met anti-PD toch ziekteprogressie lieten zien
- Immuuntherapie met Pembrolizumab (Keytruda) geeft betere resultaten dan chemotherapie als eerstelijns behandeling bij uitgezaaide gevorderde niet-kleincellige longkanker met PD-1 mutatie
- Immuuntherapie met anti-PD medicijnen: Unraveling PD-L1 Assays in NSCLC: Are They Interchangeable?
- Pembrolizumab een anti-PD medicijn geeft betere 1 jaars overleving 70% vs 54%.dan chemo en de heflt minder ernstige bijwerkingen bij onbehandelde gevorderde niet-kleincellige longkanker.
- PD-L1 Inhibition With Atezolizumab (MPDL3280A) for Solid Tumors
- Durvalumab (IMFINZI) geeft bij uitgezaaide niet-klein-cellige longkanker 11 maanden meer progressievrije tijd (44 procent) en FDA geeft durvalumab goedkeuring
- Dendritische celtherapie plus gemoduleerde T-cellen naast chemo geeft 25 procent betere mediane overall overleving op 5 jaar bij operabele niet-kleincellige longkanker copy 1
- CIMAvax-EGF vaccin geeft uitstekende resultaten op overall overleving en ziektevrije tijd bij longkanker en andere vormen van kanker met EGFR mutatie copy 1
- Immuuntherapie met T-car cells - Tumor Lymphocytic Infiltration is interessante ontwikkeling bij verschillende vormen van kanker. Hoe meer TLI hoe beter copy 1
- Immuuntherapie met Nivolumab (Opdivo) geeft geen statistisch verschil in overleving met chemo bij onbehandelde longkanker
- Immuuntherapie met bacterie naast chemo zorgt voor zeer goede resultaten bij inoperabele mesothelioma met ziektecontrole van 90 procent
- Immuuntherapie en gerichte therapie bij longkanker zijn de beste opties, maar wat zijn de verschillen en wanneer deze in te zetten?
- Nivolumab - Opdivo geeft hoopvolle resultaten bj zwaar voorbehandelde, uitgezaaide niet-klein-cellige longkanker met alsnog enkele duurzame totale remissies
- MAGE-A3 vaccin leek hoopvol voor niet-klein-cellige longkanker, maar faalt in fase III studie en studie wordt stopgezet door GSK
- Immuuntherapie met monoklonaal middel - codenaam MPDL3280A geeft bijzonder goede resultaten in fase I studie met 53 patienten met niet-klein-cellige longkanker
- Immuuntherapie bij gevorderde niet-klein-cellige longkanker lijkt een goede aanpak te kunnen worden in de nabije toekomst.
- Immuuntherapie bij longkanker: overzicht van stand van zaken aan de hand van studieresultaten van laatste 10 jaar
- Immuuntherapie bij longkanker: 131I-chTNT een antibody medicijn rechtstreeks ingespoten in de tumoren bij inoperable longkankerpatiënten zorgt voor opmerkelijke resultaten in fase I en II studies
- Immuuntherapie: 131I-chTNT een antibody medicijn rechtstreeks ingespoten in de tumoren bij inoperable longkankerpatiënten zorgt opnieuw voor opmerkelijke resultaten in Fase I-II studies.N.
- Telcyta, een immuuntherapeutisch middel zorgt voor goede resultaten in fase II trials bij patienten met niet-klein-cellige longkanker
- GVAX - een vaccin - lijkt effectief bij vergevorderde longkanker, aldus studie onder 43 patiënten gedurende drie jaar.
- Vaccin MVA-Muc1-IL2 - TG4010 - bij niet-klein-cellige longkanker geeft bemoedigende resultaten. Recente fase II studie bevestigt goede resultaten
- Vaccin gemaakt op basis van epidermal growth factor (EGF) geeft significant meer overlevingen en significant betere kwaliteit van leven bij patienten met vergevorderde niet-klein-cellige longkanker, (stadium IIIB en IV)
- Vaccinatie met Bec2/bacille Calmette-Guerin bij longkanker stadium I en II geeft geen enkel effect op langere ziektevrije tijd of overall overleving aldus gerandomiseerde fase III studie uitgevoerd mede door Nederlandse ziekenhuizen
- Immuuntherapie en vaccinaties bij longkanker: een overzicht van belangrijke studies en artikelen en recente ontwikkelingen.



Plaats een reactie ...
Reageer op "Immuuntherapie en gerichte therapie bij longkanker zijn de beste opties, maar wat zijn de verschillen en wanneer deze in te zetten?"