Aan dit artikel is enkele uren gewerkt. Opzoeken, vertalen, plaatsen enz. Als u ons wilt ondersteunen dan kan dat via een al of niet anonieme donatie. Elk bedrag is welkom hoe klein ook. Klik hier als u ons wilt helpen kanker-actueel online te houden. We zijn een ANBI organisatie, dus uw donatie is in principe aftrekbaar voor de belasting.
Lees ook het artikel: dendritische-celtherapie-gecombineerd-met-een-vaccin-gericht-op-cd-133-eiwitexpressie-voor-patienten-met-een-hersentumor-glioblastoma-multiforme-wordt-in-fase-iii-studie-onderzocht
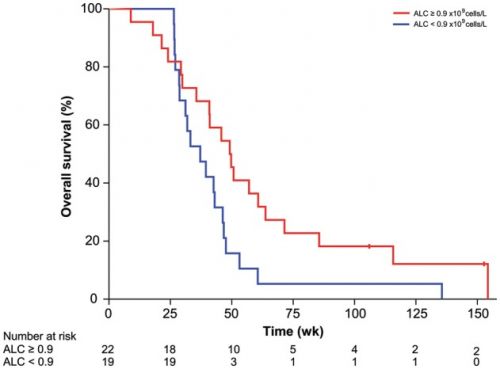
16 juni 2016: het volledige studierapport: Heat-shock protein peptide complex–96 vaccination for recurrent glioblastoma: a phase II, single-arm trial is inmiddels gratis in te zien. De studie is in 2013 beëindigd. Onderaan offciele abstract met referentielijst. Hier grafiek van overleving op einde van studie. Ik heb nergens tot nu toe follow-up resultaten kunnen vinden.
Zie ook hieronder beschrijving van deze studie.
7 mei 2013: Bron: American Association of Neurological Surgeons (AANS) 81ste Annual Meeting. Abstract 801. Gepresenteerd 1 mei 2013
Een tussenevaluatie laat zien dat immuuntherapie - dendritische celtherapie met het zogeheten heat shock protein-peptide complex-96 (HSPPC-96) vaccin uitstekende resultaten geeft naast chemo en bestraling bij mensen met nieuw
gediagnosteerde vorm van een hersentumor - glioma blastoma multiforme op de ziektevrije tijd en overall overleving in vergelijking met tot nu toe als beste zorg gehanteerde behandelingen.
Hieronder staat al meer over deze vorm van immuuntherapie maar afgelopen week werden nieuwe tussenresultaten gepubliceerd op het jaarljkse congres van de American Association of Neurological Surgeons (AASN).
De resultaten waren echt spectaculair te noemen. Een stijging van de ziektevrije tijd met 146% en 60% langere overlevingstijd. Cijfers die eigenlijk alleen nog maar beter kunnen worden omdat de paitënten die het goed doen
op deze aanpak nog steeds leven en hoe langer zij leven hoe beter de resultaten uiteraard. Andrew T. Parsa, MD, PhD, senior onderzoeker van de Universiteit van Californië in San Francisco (UCSF) maakt hierbij wel de kanttekening dat in deze studie bewust patiënten zijn opgenomen met een goede lichamelijke conditie en waar zoveel mogelijk tumorweefsel vooraf is weggehaald - er heeft optimale debulking plaatsgevonden vooraf aan de behandeling. De onderzoekers zeggen er ook wel bij dat hoe lager de tumorload, dus hoe kleiner het aantal en de omvang van de tumoren, hoe groter de kans op een goed resultaat. Ik was afgelopen week in Duitsland bij het IOZK in Keulen en ook de immunoloog daar vertelde mij dat zij de ervaring hebben dat hoe kleiner de tumorload hoe groter de kans op succes van hun aanpak met Newcastle Disease Virus en dendritische celtherapie.
De immuuntherapie met het HSPCC-96-vaccin (profaag G-100, Agenus Inc) is een behandeling die gehaald wordt uit autologe dendritische cellen geëxtraheerd uit de tumor en bloed van de patiënt. Het vaccin bevat dus een nauwkeurige zogeheten antigene "vingerafdruk" van de specifieke vorm van kanker van een patiënt en wordt gekweekt als vaccin om het immuunsysteem van het lichaam te trainen zich alleen te richten op cellen die deze vingerafdruk bevatten, waardoor het risico voor aantasting van gezond weefsel heel klein is. Het vaccin wordt bij zowel terugkerende en nieuw gediagnosticeerde GMB - hersentumor - glioma blastoma multiforme onderzocht, aldus dr. Bloch.
In onderstaand artikel kunt u ook lezen dat deze zelfde manier van immuuntherapie ook bij darmkanker en andere vormen van kanker wordt onderzocht en met succes.
Studie opzet en resultaten:
Aan de fase 2 open label, single groep studie namen 46 patiënten deel met nieuw gediagnosticeerde Glioma Blastoma Multiforme - GBM uit 8 verschillende ziekenhuizen. Bij alle patiënten werd zoveel mogelijk tumorweefsel weggehaald, hadden een goede lichamelijke conditie en bij allemaal kon voldoende tumorweefsel worden weggenomen om te gebruiken voor het kweken van het vaccin.
Na de debulking operatie ondergingen de patiënten eerst chemotherapie met temodal - temozolomide plus bestraling, daarna begon de immuuntherapie. Dit betrof wekelijks injecties met HSPP-96 de eerste 4 weken en vervolgens maandelijks, totdat de vaccin voorraad op was. De tijd tot de eerste dosis van het vaccin kon worden toegediend was 14 weken, en het gemiddelde aantal injecties met het vaccin bedroeg 9.
Het primaire doel van de studie is overlevingstijd (OS), maar de gegevens die nu zijn gepresenteerd zijn voortijdig naar buiten gebracht dus primaire einddoel kan nog niet definitief worden vastgesteld. Dr Bloch geeft aan dat er zich geen ernstige bijwerkingen hebben voorgedaan; de belangrijkste bijwerking was een huidreactie op de injectieplaats.
Bij een mediane follow-up van 13,5 maanden, hadden 27 van de 46 patiënten ziekteprogressie (59%) en 19 patiënten (41%) waren overleden. In de UCSF groep van 32 patiënten, hadden 21 patiënten (66%) ziekteprogressie. Mediane progressievrije tijd was 16,9 maanden voor de gehele studiepopulatie en 18,0 maanden in de UCSF groep, aldus dr. Bloch.
"Progressie van de ziekte deed zich veel later voor dan we zien bij een conventionele behandeling" zei dr. Bloch.
Zo bleek de mediane progressievrije tijd in andere belangrijke studies van Glioma Blastoma Multiforme - GBM behandelingen: 6,9 maanden met temodal - temozolomide (N Engl J Med 2005; 352:987-996.), 13,6 maanden met avastin - bevacizumab plus temozolomide (J Clin Oncol 2011;. 29:142-148) en 14,2 maanden met een epidermale groeifactor receptor variant III (EGFRvIII) peptide vaccin (J Clin Oncol 2010;. 28:4722-4729).
Zoals eerder gezegd waren de deelnemers in de studie van dr. Bloch wel voorgeselecteerd op lichamelijke gesteldheid en hadden vergaande debulking ondergaan. Maar dan nog zijn de resultaten opmerkelijk goed. De mediane overleving voor alle deelnmers ligt op ca. 23 maanden op moment van presentatie van deze tussenresultaten, maar kan alleen maar beter worden.
B7-H1 Antigen Expressie:
De 32 patiënten uit de UCSF groep onderging ook testen op expressie van het B7-H1 antigeen in bloedmonsters, afgenomen voor de operatie. Glioblastoma induceert systemische immuunonderdrukking door stimulatie van B7-H1 expressie, hetgeen de werkzaamheid van immunotherapie zou kunnen beïnvloeden, heeft eerder onderzoek uitgewezen.
Uit een analyse van deze groep patiënten bleek dat patiënten met een lage expressie van B7-H1 (53%) betere mediane progressievrije tijd hadden dan de patiënten met een hoge B7-H1 expressie (47%): Progressievrije tijd bleek 21,6 maanden versus 11,4 maanden te zijn respectievelijk. Deze bevinding kan ook bijdragen tot het vaststellen van een toekomstige patiëntengroep waarvan dan verwacht mag worden dat zij goed zullen reageren op deze vorm van immuuntherapie, aldus Dr Bloch.
De onderzoekers hebben nu samen met ALLIANCE, een onafhankelijke onderzoeksorganisatie, een grote gerandomiseerde fase II studie opgezet met totaal 222 patiënten die behandeld zullen worden met ofwel het HSPPC-96 vaccin samen met bevacizumab - Avastin of alleen met Avastin - bevacizumab.
Bovenstaande is gecomponeerd en vertaald uit een artikel van de website van Medscape waarop u het originele engelstalige artikel kunt lezen
4 mei 2012 Bron: American Association of Neurological Surgeons (Aans) 80e jaarlijkse wetenschappelijke bijeenkomst. Abstract # 704.
HSPPC-96, een autoloog vaccin en in feite dendritische celtherapie , verlengt het leven van mensen met een hersentumor - Glioblastoom multiforme - significant in vergelijking met een controlegroep en in vergelijking met statistische resultaten uit eerdere studies. Dit blijkt uit een fase II studie uitgevoerd in meerdere ziekenhuizen bij 43 patiënten met een recidief van een Glioblastoom multiforme en gepresenteerd op een
congres van de AANS - American Association of Neurological Surgeons. Eerder al werden resultaten over deze methode van dendritische celtherapie bekend gemaakt, zie onderaan dit artikel. Ook werd deze vorm van immuuntherapie toegepast bij darmkanker. Klik hier voor informatie daarover.
Het vaccin, HSPPC-96 - vergezeld van een zogenoemd heat-shock eiwit - wordt specifiek gemaakt voor elke patiënt persoonlijk met behulp van operatief verwijderd tumorweefsel van de patiënt in kwestie. Het vaccin maakt gebruik van het eiwit glycoproteïne-96 (gp-96). Deze specifieke antigene peptiden staan bekend om het opwekken van antitumor stoffen. Lees ook: Immuuntherapie: hoe werkt dat nu precies?
Hoe werkt deze vorm van immuuntherapie met HSPPC-96?
Eerst worden zogeheten heat-shock eiwitten en bijbehorende peptiden bij de patiënt afgenomen uit het bloed en ook wordt verwijderd tumorweefsel gebruikt. Deze worden in een laboratorium getest op biologische activiteit en teruggestuurd naar de arts binnen 48 uur na de operatie. Het vaccin wordt daarna bij de patiënt intradermaal geïnjecteerd, dat betekent tussen twee huidlagen in. Het vaccin wordt de eerste 4 weken 1 keer per week toegediend en daarna om de 2 weken tot het vaccin op is.
Resultaten:
Aan deze fase 2 studie namen 43 patiënten deel met een gemiddelde leeftijd van 53 jaar en een Karnofsky Performance Status score van ten minste 80. De patiënten die HSPPC-96 hadden gekregen overleefden mediaan 47,6 weken, en 93% van hun was nog in leven na 6 maanden. Patiënten uit een controlegroep die geen vaccin hadden gehad hadden een mediane overleving van 32,8 weken. 68% daarvan was nog in leven na 6 maanden. Historische controle patiënten uit andere studies toonden een mediane overleving van 31,4 weken en 39,8 weken. Na 6 maanden leefden nog respectievelijk 56% en 62% van deze patiënten. Patiënten verdroegen het vaccin goed en er waren geen behandelings gerelateerde graad 3 of 4 bijwerkingen gezien.
Er is nog geen abstract van de studie bekend. Er wordt wel zo snel mogelijk een gerandomiseerde fase III studie opgezet, aldus de onderzoekers tijdens het congres van de AANS. Als u hier klikt kunt u een artikel lezen uit medscape waaruit ik bovenstaand bericht heb gecomponeerd.
9 juni 2011: Bron ASCO 2011
Een vaccin, een zogeheten autoloog heat shock protein onder de codenaam HSPPC-96, gemaakt van eigen tumorweefsel, zorgt voor opmerkelijk succes bij mensen met een geheel of gedeeltelijk operabele hersentumor. De mediane overlevingstijd is nu al tijdens een tussenevaluatie 2 tot 3 keer zo lang in vergelijking met statistische gegevens van zelfde groep van patienten. En van de 33 deelnemende patienten (allemaal begonnen aan deze aanpak na hun eerste recidief van een Glioblastoom multiforme) zijn er nog steeds 11 in leven, waarvan 7 al meer dan een jaar. Deze resultaten van een fase II studie werd op ASCO 2011 gepresenteerd. Hier het abstract van de studie:
Autologous heat shock protein vaccine (HSPPC-96) for patients with recurrent glioblastoma (GBM): Results of a phase II multicenter clinical trial with immunological assessments.
J Clin Oncol 29: 2011 (suppl; abstr 2565)
Author(s): A. Parsa, C. Crane, S. Han, V. Kivett, A. Fedoroff, N. A. Butowski, S. M. Chang, J. L. Clarke, M. S. Berger, M. McDermott, M. Aghi, C. Yanes, M. Prados, A. E. Sloan, J. N. Bruce; University of California, San Francisco, San Francisco, CA; University Hospital Case Medical Center, Cleveland, OH; Columbia University Medical Center, New York, NY Abstract: Background: HSPPC-96 is derived from a patient’s individual tumor and contains glycoprotein-96 (gp96) polypeptide associated with cancer-specific antigenic peptides.
Methods: This ongoing single-arm multicenter Phase 2 trial is designed to evaluate overall survival (primary objective) and immunologic response (secondary objective) with HSPPC-96 in patients with first or subsequent recurrence of GBM. Prior treatment with radiotherapy and temozolomide was required. All patients underwent a >90% resection of the recurrence. Vaccine therapy was to be initiated within 5 weeks post-surgery and consisted of 25 µg HSPPC-96, given ID weekly x 4, followed by bi-weekly injections for up to 52 weeks.
Results: A total of 33 patients at first recurrence (M:F = 25:8) with a median KPS of 80 were entered. A median of 6 injections (range: 1-15) were administered to the ITT population, with a requisite of 4 vaccinations for the evaluable population. The vaccine was well tolerated with no attributed serious adverse events and no related grade 3 or 4 toxicities. Injection site reaction was seen in 12 patients and fatigue was reported in 9 patients. As of Jan. 2011, the median survival (KM estimates) is 324 days for ITT population (37-877) and 333 days for evaluable population (99-877). 11 patients are still alive and being followed, including 4 beyond one year (374d, 419d, 578d, and 877 days, respectively). All patients with immunological endpoints tested to date exhibited a significant innate immune response and all patients demonstrated CD8 T cell IFN gamma production upon restimulation with autologous gp-96; following vaccine administration.
Conclusions: HSPPC-96 evokes a specific and innate immune response in patients with recurrent glioma and survival data available to date indicates HSPPC-96 vaccine provides a possible clinical benefit with a favorable safety profile. Collectively these results provide the impetus for Phase 3 testing against currently approved therapies for patients with recurrent glioblastoma.
The HSPPC-96 vaccine is safe and warrants further study of efficacy for the treatment of recurrent GBM. Significant pretreatment lymphopenia may impact the outcomes of immunotherapy and deserves additional investigation.
Heat-shock protein peptide complex–96 vaccination for recurrent glioblastoma: a phase II, single-arm trial
Abstract
Background
Outcomes for patients with recurrent glioblastoma multiforme (GBM) are poor and may be improved by immunotherapy. We investigated the safety and efficacy of an autologous heat-shock protein peptide complex–96 (HSPPC-96) vaccine for patients with recurrent GBM.
Methods
In this open-label, single-arm, phase II study, adult patients with surgically resectable recurrent GBM were given vaccine after gross total resection. The primary endpoint was overall survival at 6 months. Secondary endpoints included overall survival, progression-free survival, safety, and immune profiling. Outcome analyses were performed in the intention-to-treat and efficacy populations.
Results
Between October 3, 2007 and October 24, 2011, 41 patients underwent gross total resection of recurrent GBM and received a median of 6 doses of HSPPC-96 vaccine. Following treatment, 90.2% of patients were alive at 6 months (95% confidence interval : 75.9–96.8) and 29.3% were alive at 12 months (95% CI: 16.6–45.7). Median overall survival was 42.6 weeks (95% CI: 34.7–50.5). Twenty-seven (66%) patients were lymphopenic prior to therapy, and patients with lymphocyte counts below the cohort median demonstrated decreased overall survival (hazard ratio: 4.0; 95% CI: 1.4–11.8; P = .012). There were no treatment-related deaths. There were 37 serious (grades 3–5) adverse events reported, with 17 attributable to surgical resection and a single grade 3 constitutional event related to the vaccine.
Conclusion
The HSPPC-96 vaccine is safe and warrants further study of efficacy for the treatment of recurrent GBM. Significant pretreatment lymphopenia may impact the outcomes of immunotherapy and deserves additional investigation.
References
Gerelateerde artikelen
- CAR-T celtherapie maakt dat kinderen met neuroblastoma nu in 2025 al meer dan 10 jaar kankervrij zijn. Met uitgelicht een prachtig overlevingsverhaal van een kind van 4 jaar die anno 2025 al 19 jaar kankervrij is. copy 1
- Immuuntherapie met specifieke CAR-T cel behandeling (GD2-CAR T cel behandeling) blijkt ook effectief bij kinderen en jong volwassen patienten met een hersentumor.
- CAR-T celtherapie rechtstreeks toegediend in de hersenen doet tumorweefsel van Glioblastoma Multiforma snel slinken en soms zelfs verdwijnen.
- Gepersonaliseerde vorm van immuuntherapie succesvol bij melanomen gegeven voor operatie doet hersentumor type Glioblastoma Multiforme van arts verdwijnen en er is nog geen teken van recidief na 1 jaar.
- mRNA vaccin doet hersentumoren type Glioblastoma razendsnel veranderen van koude tumoren in warme tumoren. Blijkt uit eerste klinische studie bij volwassen patienten en bevestigt resultaten uit dierstudies
- DCVax-L verbetert overall overleving en vermindert kans op recidief bij patiënten met nieuw gediagnosticeerd glioblastoom en recidiverend glioblastoom in vergelijking met beste standaardzorg
- Craniopharyngiomas, goedaardige inoperabele primaire hersentumoren van de hypofyse-hypothalamus-as met BRAF V600E mutaties reageren bijzonder goed op combinatiebehandeling van vemurafenib + cobimetinib
- Immuuntherapie met Natural Killer cellen en opgekweekte versterkte autologe T-cellen geeft verrassend goede resultaten bij patienten met een recidief van een hersentumor type glioblastoom multiforme
- Immuuntherapie met cocktail van 9 niet-toxische medicijnen - middelen bij hersentumoren van het type Glioblastoma Multiforme blijkt veilig en geeft veelbelovende resultaten bij eerste 9 patienten uit studie van prof. dr. Halatsch
- Lage tumor mutatie belasting geeft een langere overleving bij patienten met een recidief van een glioblastoom wanneer deze behandeld zijn met immuuntherapie met een gemoduleerd poliovirus of anti-PD medicijn
- Meisje van drie jaar komt en blijft in een complete remissie van een hersentumor glioblastoma met larotrectinib een zogeheten TRK medicijn op basis van haar ETV6–NTRK3 mutatie. copy 1
- Surviving terminal cancer: kunnen overlevenden van een hersentumor helpen kanker te overwinnen? Drie mannen overwonnen hun hersentumor - GBM - en 2 ervan zijn al 15 en 20 jaar vrij van kanker met eigen cocktail van bewezen niet-toxische middelen. copy 1 c
- Immuuntherapie met anti-PD medicijnen (pembrolizumab en / of nivolumab) geeft geen effect op overall overleving bij zwaar voorbehandelde patienten met glioblastoma multiforme
- Immuuntherapie met gemoduleerd poliovirus blijkt succesvol bij recidief van hersentumoren van het type glioblastoma multiforme graad IV
- Inovio Pharmaceuticals Initiates Immuno-Oncology Clinical Study for Glioblastoma in Combination with Regeneron’s PD-1 Inhibitor
- immuuntherapie met rindopepimut een vaccin (gericht op EGFR mutatie) naast temozolomide geeft geen enkel verschil in overall overleving in vergelijking met alleen temozolomide bij hersentumoren Glioblastoma met weinig of geen restweefsel na operatie
- Immuuntherapie met dendritische celtherapie voor hersentumoren type glioblastoma multiforme geeft 20 en 14 procent overall overleving versus 4 en 0 procent op 3 en 5 jaar .
- Dendritische celtherapie bij glioblastoma multiforme graad IV direct na bestraling plus temodal geeft langere overall overleving. 46 procent leeft nog na 3 jaar
- Nivolumab faalt bij recidief van een hersentumor Glioblastoma multiforme. Fase III studie Checkmate 143 wordt stopgezet
- Immuuntherapie met specifiek geprepareerde dendritische cellen (APVACS) plus tetanus virus (CMV) geeft superieure duurzame resultaten op ziektevrije tijd en overall overleving
- Immuuntherapie met gemoduleerd herpesvirus - AdV-Tk therapy - na operatie zorgt voor hoog significant meer en langere overleving in vergelijking met standaardbehandeling bij hersentumoren Glioblastoma multiforme
- APVACS - actief gepersonaliseerde vaccins - ontwikkelen tegen kanker wordt doel van nieuw consortium van 14 organisaties - GAPVAC, waaronder LUMC Leiden
- Toca 511 & Toca FC, een vorm van immuuntherapie met een gemodificeerd virus in combinatie met 5-FU bij hersentumoren - glioblastoma multiforme, heeft de eerste patiënt in behandeling genomen
- Dendritische celtherapie gecombineerd met een vaccin gericht op CD-133 eiwitexpressie voor patiënten met een hersentumor glioblastoma multiforme wordt in fase I/II studie onderzocht
- Behandeling met een virus - Delta-24-RDG - voor hersentumoren - glioblastoma multiforme wordt onderzocht in een fase I /II studie in het VUmc - Amsterdam
- Dendritische celtherapie gecombineerd met zogeheten mRNA's - cellen uit tumoren - verdriedubbeld overlevingstijd van mensen met een hersentumor - glioblastoma multiforme. copy 1
- Vaccin gemaakt van eigen tumorweefsel (HSPPC-96) verlengt leven 2 tot 3 keer zo lang van mensen met een geheel of gedeeltelijke operabele hersentumor. Dit.blijkt uit tussenevaluatie van fase II studie gepresenteerd op ASCO 2011
- Dendritische celtherapie met autoloog vaccin gebaseerd op antigenen geeft significant langere ziektevrije tijd en overall overleving bij patiënten met een hersentumor - glioblastoom
- Dendritische celtherapie vooral ook succesvol toepasbaar bij hersentumoren
- Immuuntherapie bij hersentumoren: Dendritische cellen toegediend na operatie van hersentumoren zorgt voor opmerkelijk goede kansen op geen recidief aldus resultaten uit kleinschalige studie bij 23 patiënten.
- Immuuntherapie bij hersentumoren: Dendritische cellen toegediend na operatie van hersentumoren zorgt voor opmerkelijk goede kansen op geen recidief aldus resultaten uit kleinschalige studie bij 12 patiënten.
- Immuuntherapie met synthetisch vaccin brengt enkele kinderen met een hersentumor - glioblastoom in een totale remissie
- Vaccin dat hersentumoren (Glioblastoom multiforme) met EGFRvIII expressie bestrijdt geeft verdubbeling van overlevingstijd en progressievrije tijd bij nieuw gediagnosteerde patienten
- Neuroblastomen: Immuuntherapie met chimeric anti-GD2 antibody ch 14.18 verhoogt significant overall overleving na 2 jaar met 20% t.o.v. alleen chemotherapie plus stamceltherapie.
- Stamcellen uit eigen bloed naast zware chemokuren geeft kinderen met recidief van hersentumoren langere overlevingstijd en kans op totale genezing, maar ook overlijdt 1 op de 4 kinderen aan de gevolgen van de behandeling
- Virussen: Herpes virusachtig medicijn - G207 wordt in fase I trial onderzocht bij kwaadaardige Glioma tumoren waarvoor radiotherapie - bestraling of chemo niet meer werkt en dus uitbehandeld zijn.
- Immuuntherapie bij hersentumoren met vaccins en virussen waaronder Newcastle Disease Virus. Een overzicht van recente ontwikkelingen.



Plaats een reactie ...
Reageer op "Vaccin gemaakt van eigen tumorweefsel (HSPPC-96) verlengt leven 2 tot 3 keer zo lang van mensen met een geheel of gedeeltelijke operabele hersentumor. Dit.blijkt uit tussenevaluatie van fase II studie gepresenteerd op ASCO 2011"