Mocht u kanker-actueel de moeite waard vinden en ons willen ondersteunen om kanker-actueel online te houden dan kunt u ons machtigen voor een periodieke donatie via donaties: https://kanker-actueel.nl/NL/donaties.html of doneer al of niet anoniem op - rekeningnummer NL79 RABO 0372931138 t.n.v. Stichting Gezondheid Actueel in Amersfoort. Onze IBANcode is NL79 RABO 0372 9311 38
Elk bedrag is welkom. En we zijn een ANBI instelling dus uw donatie of gift is in principe aftrekbaar voor de belasting.
En als donateur kunt u ook korting krijgen bij verschillende bedrijven:
12 augustus 2017: lees ook dit artikel:
18 april 2017: Bron: Clinical Cancer Research
Nieuwe studiegegevens bevestigen dat dendritische celtherapie met een zogeheten cytomegalovirus en specifiek gericht op bepaalde eiwitexpressie (pp65 - APVAC studies, waaraan o.a. UMCL - Leiden meedoet) voor langdurige overleving zorgt bij patiënten met nieuw gediagnosteerde hersentumoren van het type glioblastoma multiforma. Van de 11 patiënten die in aanmerking kwamen voor een eindevaluatie was de nog niet bereikte mediane overall overleving al 41,1 maanden op moment van de tussenanalyse. 4 patienten zijn inmiddels langer dan 5 jaar kankervrij en in leven. Zie onder grafiek verdere informatie in een ook al eerder geschreven artikel.
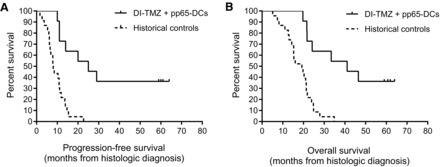
Zie dit volledige studierapport: Long-term Survival in Glioblastoma with Cytomegalovirus pp65-Targeted Vaccination gepubliceerd in Clinical Cancer research.
11 november 2016: Bron: Medscape, Nature en Duke University
Immuuntherapie met een zogeheten cytomegalovirus (CMV)-targeted dendritic cell vaccin (ook wel APVACS genoemd) verbetert sterk de ziektevrije tijd en overall overleving bij patiënten met een hersentumor - glioblastoma. Aldus de resultaten uit twee fase II studies.
"CMV pp65-DC vaccins worden geassocieerd met superieure overall overleving in verschillende klinische studies die de keuze versterkt voor immuuntherapie met CMV om een lange duurzame overleving te bereiken." zegt studieleider Kristen A. Batich, an MD candidate in the Division of Neurosurgery at Duke University Medical Center, Durham, North Carolina ion een presentatie op de American Association of Neurological Surgeons (AANS) 84th Annual Meeting in Chigaco.
In eerder onderzoek bij muizen en nu bij ook patienten: http://www.nature.com/nature/journal/v519/n7543/full/nature14320.html beschrijven Batich en collega's de overlevingsdata van de dubbelblind gerandomiseerde ATTAC studie, een kleine maar hoopgevende studie bij 12 patienten met een hersentumor van het type glioblastoma. Met 30 procent van de patienten nog in leven op 5 jaar en langer.
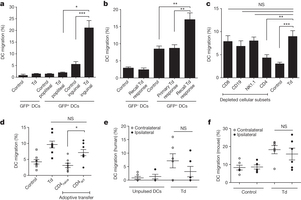
Studieresultaten:
De patiënten werden gerandomiseerd ingedeeld voor of een behandeling met het dendritische cel vaccin, gericht op het CMV pp65 antigen, samen met een geprepareerd vaccin met een tetanus virus om de response op de immuuntherapie te versterken of met onbewerkte dendritische cellen. Alle patiënten kregen ook standaard bestraling - radiotherapie en een chemokuur met Temodal - temozolomide (TMZ) 200 mg / m2 gedurende 5 dagen.
"In deze studie bleek bij de patiënten in de groep die geen tetanus virus kregen de mediane overall overleving 11.6 maanden van het moment dat het vaccin werd toegediend tot 18,5 maanden vanaf het moment van opereren", aldus dr. Batich.
"Dit is nog altijd beter dan mocht worden verwacht van de overall overleving op basis van een standaard behandeling welke een mediane overall overleving heeft van 14,6 maanden, aldus dr. Batich
Patienten die gerandomiseerd waren ingedeeld voor de op het pp65 gen gerichte dendritische cellen gecombineerd met het tetanusvirus toonden een veel betere respons op de behandeling met een overall overleving van 57.2 maanden tot 120.4 maanden (= dus gewoon 5 tot 10 jaar overleving met een hersentumor glioblastoma!!!!!!), welke dus veel beter is in vergelijking met de niet tetanusgroep. Bovendien waren drie van de 6 patienten nog in leven op het moment van de studie analyse dus dat verschil wordt alleen nog maar groter.
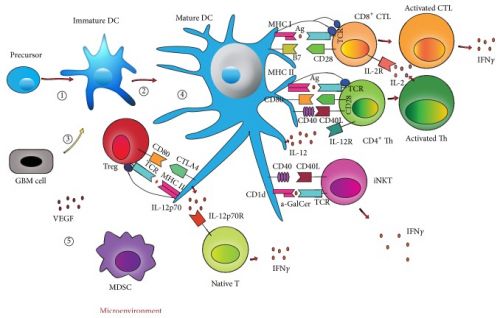
Heel opmerkelijk, "1 patiënt uit de tetanusgroep heeft tot nu toe nog geen recidief gehad en is nog steeds op ruim 10 jaar ziektevrij en in leven." aldus dr. Batich. Hieronder een schema van hoe deze aanpak werkt, maar ik vermoed dat alleen echte deskundigen dit begrijpen. Tekst gaat onder dit plaatje verder met beschrijving van andere vervolgstudie.
Vervolgstudie:
Voor de opvolgende eenarmige fase 2 ATTAC-GM studie werden 11 patiënten behandeld met hogere doses Temodal - TMZ (100 mg / m2 gedurende 21 dagen) en radiotherapie - bestraling, naast het dendritische cel vaccin gericht op de pp65 en met het gemoduleerde tetanusvirus.
In deze tweede studie, vertoonden patiënten verder een aanzienlijke stijging van de pp65 dendritische cel reacties (p = 0,0186), met een immunogeniciteit beoordeeld met de pp65-specifieke ELISpot.
De tweede studie toonde ook een aanzienlijke stijging van de mediane progressievrije overleving (25,3 maanden) en de overall overleving (41,1 maanden).
Van de 11 patiënten waren er nog 4 patiënten progressievrij ten tijde van de overlevingsanalyse op 59 tot 64 maanden na de diagnose.
Dr. Batich merkt op dat de onderzoekers nog steeds proberen te achterhalen of de verbeterde overleving voor het grootste deel gerelateerd is aan het CMV antigen of aan het gemoduleerde tetanus virus of beide.
"De overleving is mogelijk het resultaat van beide behandelingen maar de eerste gerandomiseerde ATTACK studie was natuurlijk met slechts 12 patiënten (6 om 6 per groep)."
"Interessant is dat de patiënten die het tetanus virus toegediend kregen voor het CMV vaccin een langere overall overleving schijnen te bewerkstelligen," zegt dr. Batich. "Dit zou gerelateerd kunnen zijn aan de mogelijkheid die het tetanus virus heeft om de migratie van het CMV dendrische cel vaccin naar de lokale lymfklieren te verbeteren."
"Alles samenvattend het aandeel van of een gericht CMV vaccin of een tetanus virus samen emt dendritiche cellen zal moeten worden onderzocht in grotere gerandomiseerde studies met meer patiënten."
Belangrijk is dat het CMV vaccin een groot veiligheidsprofiel heeft.
"Een van de belangrijkste voordelen van immuuntherapie met vaccins zoals het gerichte CMV vaccin is de kwaliteit van leven voor de patiënten," aldus dr. Batich.
"Anders dan bij een enkelvoudig vaccin zoals een tetanus injectie of een griepinjectie dat soms lokale zwellingen, ontstekingen en koorts kan veroorzaken zijn bij deze combinatie therapie geen noemenswaardige bijwerkingen."
"Dit vaccin bevat eigen cellen van de patiënt die zijn opgeleid om zich te richten op CMV eiwitten in het lichaam, dus het is heel specifiek," zo besluit dr. Batich.
Batich and coauthors hold patents related to technologies described in the study. The research was funded in part through a National Institutes of Health (NIH) STTR phase I grant to Annias Immunotherapeutics, a Duke start-up venture, presently finalizing an exclusive license to the technology. The study also received funding from grants from the National Institute of Neurological Disorders and Stroke, a unit of the NIH, and from the NIH, the American Brain Tumor Association, the National Brain Tumor Society, the Accelerate Brain Cancer Cure Foundation, the Kinetics Foundation, the Ben and Catherine Ivy Foundation, and in part by Duke University's Clinical & Translational Science Awards grant 1UL2 RR024128-01 from the NIH National Center for Research Resources.
American Association of Neurological Surgeons (AANS) 84th Annual Meeting. Abstract 701. Presented May 3, 2016.
Hier het studieprotocol die loopt aan de Duke university:
Evaluation of overcoming Limited migration and Enhancing cytomegalovirus-specific dendritic cell Vaccines with Adjuvant TEtanus pre-conditioning in patients with newly-diagnosed glioblastoma.
Andere interessante studie is deze review studie over immuuntherapie bij hersentumoren:
Dendritic Cell-Based Immunotherapy Treatment for Glioblastoma Multiforme
Abstracten van bovenstaande eerder beschreven studies staan hieronder:
CMV pp65-DC vaccines are associated with superior overall survival in brain tumors - glioblastomas
Dendritic Cell-Based Immunotherapy Treatment for Glioblastoma Multiforme.
Abstract
Glioblastoma multiforme (GBM) is the most malignant glioma and patients diagnosed with this disease had poor outcomes even treated with the combination of conventional treatment (surgery, chemotherapy, and radiation). Dendritic cells (DCs) are the most powerful antigen presenting cells and DC-based vaccination has the potential to target and eliminate GBM cells and enhance the responses of these cells to the existing therapies with minimal damage to the healthy tissues around them. It can enhance recognition of GBM cells by the patients' immune system and activate vast, potent, and long-lasting immune reactions to eliminate them. Therefore, this therapy can prolong the survival of GBM patients and has wide and bright future in the treatment of GBM. Also, the efficacy of this therapy can be strengthened in several ways at some degree: the manipulation of immune regulatory components or costimulatory molecules on DCs; the appropriate choices of antigens for loading to enhance the effectiveness of the therapy; regulation of positive regulators or negative regulators in GBM microenvironment.
- PMID:
- 26167495
- PMCID:
- PMC4488155
- DOI:
- 10.1155/2015/717530
Tetanus toxoid and CCL3 improve dendritic cell vaccines in mice and glioblastoma patients
Tetanus toxoid and CCL3 improve dendritic cell vaccines in mice and glioblastoma patients
- Nature
- 519,
- 366–369
- doi:10.1038/nature14320
- Received
- Accepted
- Published online
After stimulation, dendritic cells (DCs) mature and migrate to draining lymph nodes to induce immune responses1. As such, autologous DCs generated ex vivo have been pulsed with tumour antigens and injected back into patients as immunotherapy. While DC vaccines have shown limited promise in the treatment of patients with advanced cancers2, 3, 4 including glioblastoma5, 6, 7, the factors dictating DC vaccine efficacy remain poorly understood. Here we show that pre-conditioning the vaccine site with a potent recall antigen such as tetanus/diphtheria (Td) toxoid can significantly improve the lymph node homing and efficacy of tumour-antigen-specific DCs. To assess the effect of vaccine site pre-conditioning in humans, we randomized patients with glioblastoma to pre-conditioning with either mature DCs8 or Td unilaterally before bilateral vaccination with DCs pulsed with Cytomegalovirus phosphoprotein 65 (pp65) RNA. We and other laboratories have shown that pp65 is expressed in more than 90% of glioblastoma specimens but not in surrounding normal brain9, 10, 11, 12, providing an unparalleled opportunity to subvert this viral protein as a tumour-specific target. Patients given Td had enhanced DC migration bilaterally and significantly improved survival. In mice, Td pre-conditioning also enhanced bilateral DC migration and suppressed tumour growth in a manner dependent on the chemokine CCL3. Our clinical studies and corroborating investigations in mice suggest that pre-conditioning with a potent recall antigen may represent a viable strategy to improve anti-tumour immunotherapy.
Subject terms:
At a glance
Gerelateerde artikelen
- CAR-T celtherapie maakt dat kinderen met neuroblastoma nu in 2025 al meer dan 10 jaar kankervrij zijn. Met uitgelicht een prachtig overlevingsverhaal van een kind van 4 jaar die anno 2025 al 19 jaar kankervrij is. copy 1
- Immuuntherapie met specifieke CAR-T cel behandeling (GD2-CAR T cel behandeling) blijkt ook effectief bij kinderen en jong volwassen patienten met een hersentumor.
- CAR-T celtherapie rechtstreeks toegediend in de hersenen doet tumorweefsel van Glioblastoma Multiforma snel slinken en soms zelfs verdwijnen.
- Gepersonaliseerde vorm van immuuntherapie succesvol bij melanomen gegeven voor operatie doet hersentumor type Glioblastoma Multiforme van arts verdwijnen en er is nog geen teken van recidief na 1 jaar.
- mRNA vaccin doet hersentumoren type Glioblastoma razendsnel veranderen van koude tumoren in warme tumoren. Blijkt uit eerste klinische studie bij volwassen patienten en bevestigt resultaten uit dierstudies
- DCVax-L verbetert overall overleving en vermindert kans op recidief bij patiënten met nieuw gediagnosticeerd glioblastoom en recidiverend glioblastoom in vergelijking met beste standaardzorg
- Craniopharyngiomas, goedaardige inoperabele primaire hersentumoren van de hypofyse-hypothalamus-as met BRAF V600E mutaties reageren bijzonder goed op combinatiebehandeling van vemurafenib + cobimetinib
- Immuuntherapie met Natural Killer cellen en opgekweekte versterkte autologe T-cellen geeft verrassend goede resultaten bij patienten met een recidief van een hersentumor type glioblastoom multiforme
- Immuuntherapie met cocktail van 9 niet-toxische medicijnen - middelen bij hersentumoren van het type Glioblastoma Multiforme blijkt veilig en geeft veelbelovende resultaten bij eerste 9 patienten uit studie van prof. dr. Halatsch
- Lage tumor mutatie belasting geeft een langere overleving bij patienten met een recidief van een glioblastoom wanneer deze behandeld zijn met immuuntherapie met een gemoduleerd poliovirus of anti-PD medicijn
- Meisje van drie jaar komt en blijft in een complete remissie van een hersentumor glioblastoma met larotrectinib een zogeheten TRK medicijn op basis van haar ETV6–NTRK3 mutatie. copy 1
- Surviving terminal cancer: kunnen overlevenden van een hersentumor helpen kanker te overwinnen? Drie mannen overwonnen hun hersentumor - GBM - en 2 ervan zijn al 15 en 20 jaar vrij van kanker met eigen cocktail van bewezen niet-toxische middelen. copy 1 c
- Immuuntherapie met anti-PD medicijnen (pembrolizumab en / of nivolumab) geeft geen effect op overall overleving bij zwaar voorbehandelde patienten met glioblastoma multiforme
- Immuuntherapie met gemoduleerd poliovirus blijkt succesvol bij recidief van hersentumoren van het type glioblastoma multiforme graad IV
- Inovio Pharmaceuticals Initiates Immuno-Oncology Clinical Study for Glioblastoma in Combination with Regeneron’s PD-1 Inhibitor
- immuuntherapie met rindopepimut een vaccin (gericht op EGFR mutatie) naast temozolomide geeft geen enkel verschil in overall overleving in vergelijking met alleen temozolomide bij hersentumoren Glioblastoma met weinig of geen restweefsel na operatie
- Immuuntherapie met dendritische celtherapie voor hersentumoren type glioblastoma multiforme geeft 20 en 14 procent overall overleving versus 4 en 0 procent op 3 en 5 jaar .
- Dendritische celtherapie bij glioblastoma multiforme graad IV direct na bestraling plus temodal geeft langere overall overleving. 46 procent leeft nog na 3 jaar
- Nivolumab faalt bij recidief van een hersentumor Glioblastoma multiforme. Fase III studie Checkmate 143 wordt stopgezet
- Immuuntherapie met specifiek geprepareerde dendritische cellen (APVACS) plus tetanus virus (CMV) geeft superieure duurzame resultaten op ziektevrije tijd en overall overleving
- Immuuntherapie met gemoduleerd herpesvirus - AdV-Tk therapy - na operatie zorgt voor hoog significant meer en langere overleving in vergelijking met standaardbehandeling bij hersentumoren Glioblastoma multiforme
- APVACS - actief gepersonaliseerde vaccins - ontwikkelen tegen kanker wordt doel van nieuw consortium van 14 organisaties - GAPVAC, waaronder LUMC Leiden
- Toca 511 & Toca FC, een vorm van immuuntherapie met een gemodificeerd virus in combinatie met 5-FU bij hersentumoren - glioblastoma multiforme, heeft de eerste patiënt in behandeling genomen
- Dendritische celtherapie gecombineerd met een vaccin gericht op CD-133 eiwitexpressie voor patiënten met een hersentumor glioblastoma multiforme wordt in fase I/II studie onderzocht
- Behandeling met een virus - Delta-24-RDG - voor hersentumoren - glioblastoma multiforme wordt onderzocht in een fase I /II studie in het VUmc - Amsterdam
- Dendritische celtherapie gecombineerd met zogeheten mRNA's - cellen uit tumoren - verdriedubbeld overlevingstijd van mensen met een hersentumor - glioblastoma multiforme. copy 1
- Vaccin gemaakt van eigen tumorweefsel (HSPPC-96) verlengt leven 2 tot 3 keer zo lang van mensen met een geheel of gedeeltelijke operabele hersentumor. Dit.blijkt uit tussenevaluatie van fase II studie gepresenteerd op ASCO 2011
- Dendritische celtherapie met autoloog vaccin gebaseerd op antigenen geeft significant langere ziektevrije tijd en overall overleving bij patiënten met een hersentumor - glioblastoom
- Dendritische celtherapie vooral ook succesvol toepasbaar bij hersentumoren
- Immuuntherapie bij hersentumoren: Dendritische cellen toegediend na operatie van hersentumoren zorgt voor opmerkelijk goede kansen op geen recidief aldus resultaten uit kleinschalige studie bij 23 patiënten.
- Immuuntherapie bij hersentumoren: Dendritische cellen toegediend na operatie van hersentumoren zorgt voor opmerkelijk goede kansen op geen recidief aldus resultaten uit kleinschalige studie bij 12 patiënten.
- Immuuntherapie met synthetisch vaccin brengt enkele kinderen met een hersentumor - glioblastoom in een totale remissie
- Vaccin dat hersentumoren (Glioblastoom multiforme) met EGFRvIII expressie bestrijdt geeft verdubbeling van overlevingstijd en progressievrije tijd bij nieuw gediagnosteerde patienten
- Neuroblastomen: Immuuntherapie met chimeric anti-GD2 antibody ch 14.18 verhoogt significant overall overleving na 2 jaar met 20% t.o.v. alleen chemotherapie plus stamceltherapie.
- Stamcellen uit eigen bloed naast zware chemokuren geeft kinderen met recidief van hersentumoren langere overlevingstijd en kans op totale genezing, maar ook overlijdt 1 op de 4 kinderen aan de gevolgen van de behandeling
- Virussen: Herpes virusachtig medicijn - G207 wordt in fase I trial onderzocht bij kwaadaardige Glioma tumoren waarvoor radiotherapie - bestraling of chemo niet meer werkt en dus uitbehandeld zijn.
- Immuuntherapie bij hersentumoren met vaccins en virussen waaronder Newcastle Disease Virus. Een overzicht van recente ontwikkelingen.
















Plaats een reactie ...
Reageer op "Immuuntherapie met specifiek geprepareerde dendritische cellen (APVACS) plus tetanus virus (CMV) geeft superieure duurzame resultaten op ziektevrije tijd en overall overleving"