Als u kanker-actueel de moeite waard vindt wilt u misschien ons steunen met een donatie. En als donateur heeft u een aantal voordelen en kunt u bv. korting krijgen bij verschillende bedrijven.
Lees en bekijk ook de patientenverhalen van Jeannette Ter Stege en Fons de Visser
30 september 2018: Bron: Neurology: First published August 31, 2018
Immuuntherapie met de anti-PD medicijnen nivolumab en pembrolizumab aan patiënten met een recidief van een hersentumor van het type glioblastoma multiforme veranderde niets aan de tijd van progressievrije ziekte en overall overleving in vergelijking met een standaard palliatieve behandeling met bv. bevacizumab ( Avastin). Dit blijkt uit een retrospectieve studieanalyse van 31 patiënten die uit compassionate use deze behandeling hadden gekregen.
Mediane progressievrije overleving (mPFS) vanaf de eerste injectie met een anti–PD-1 medicijn was 3.2 maanden (95% confidence interval 2.2–4.2), en er bleek geen verschil tussen nivolumab (mPFS 3.8 maanden, 95% CI 1.7–5.8) vergeleken met pembrolizumab (mPFS 2.3 maanden, 95% CI 1.7–2.8, log rank 3.1, p = 0.08).
Er was ook geen verschil in mediane progressievrije ziekte (mPFS) als patienten eerder wel bevacizumab (Avastin) hadden gehad, (mPFS 3.2 maanden, 95% CI 2–4.3) of geen bevacizumab (Avastin) hadden gehad (mPFS 3.7, 95% CI 0–7.9, log rank 1.3, p = 0.3).
De mediane overall overleving was na de eerste injectie met een anti-PD medicijn 6,6 maanden. (95% CI 4.2–9.1).
Al eerder was de checkmate studie 143 stopgezet (zie in gerelateerde artikelen) omdat nivolumab geen verschil te zien gaf in overall overleving bij dezelfde groep van patienten, dus bij patienten met een recidief van een hersentumor glioblastoma multiforme na de standaard eerstelijns behandeling.
Onderstaande afbeelding komt uit een artikel dat juist wel immuuntherapie met anti-PD medicijnen ziet als hoopvol. Maar de bewijzen zijn er dus nog niet. Zie ook referentielijst onderaan dit artikel.
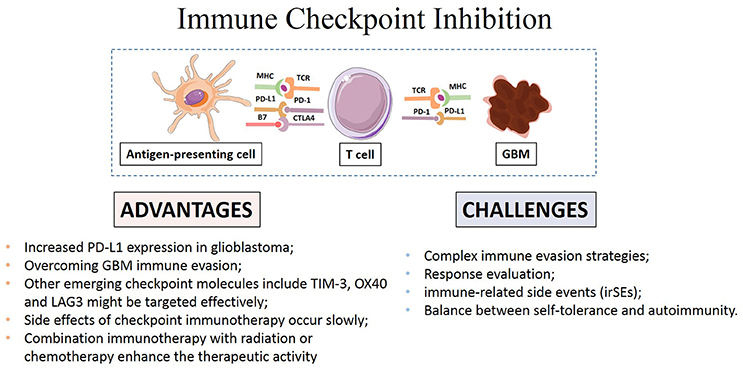 Source: Frontiers/immunotherapy
Source: Frontiers/immunotherapy
Het volledige studierapport van de studie: PD-1 inhibition has only limited clinical benefit in patients with recurrent high-grade glioma is tegen betaling in te zien.
Hier het abstract van de studie:
Salvage therapy with nivolumab or pembrolizumab with or without bevacizumab does not confer a survival benefit in this heavily pretreated unselected patient population.
PD-1 inhibition has only limited clinical benefit in patients with recurrent high-grade glioma
References
(2016). Immune checkpoint inhibition is effective in hypermutant Glioblastoma. Cancer Discov. 6:OF7. doi: 10.1158/2159-8290.CD-RW2016-060
Ansell, S. M., Lesokhin, A. M., Borrello, I., Halwani, A., Scott, E. C., Gutierrez, M., et al. (2015). PD-1 blockade with nivolumab in relapsed or refractory Hodgkin's lymphoma. N. Engl. J. Med. 372, 311–319. doi: 10.1056/NEJMoa1411087
Ardon, H., Van Gool, S. W., Verschuere, T., Maes, W., Fieuws, S., Sciot, R., et al. (2012). Integration of autologous dendritic cell-based immunotherapy in the standard of care treatment for patients with newly diagnosed glioblastoma: results of the HGG-2006 phase I/II trial. Cancer Immunol. Immunother. 61, 2033–2044. doi: 10.1007/s00262-012-1261-1
Asaoka, Y., Ijichi, H., and Koike, K. (2015). PD-1 blockade in tumors with mismatch-repair deficiency. N. Engl. J. Med. 373:1979. doi: 10.1056/NEJMc1510353
Aspelund, A., Antila, S., Proulx, S. T., Karlsen, T. V., Karaman, S., Detmar, M., et al. (2015). A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. J. Exp. Med. 212, 991–999. doi: 10.1084/jem.20142290
Barthel, S. R., and Schatton, T. (2016). Homing in on the sweet side of immune checkpoint biology. Immunity 44, 1083–1085. doi: 10.1016/j.immuni.2016.05.003
Baruch, K., Deczkowska, A., Rosenzweig, N., Tsitsou-Kampeli, A., Sharif, A. M., Matcovitch-Natan, O., et al. (2016). PD-1 immune checkpoint blockade reduces pathology and improves memory in mouse models of Alzheimer's disease. Nat. Med. 22, 135–137. doi: 10.1038/nm.4022
Bhatia, S., and Thompson, J. A. (2014). Melanoma: immune checkpoint blockade story gets better. Lancet 384, 1078–1079. doi: 10.1016/S0140-6736(14)61140-5
Bordon, Y. (2016). Tumour immunology: a checkpoint for NK cells. Nat. Rev. Immunol. 16, 402–403. doi: 10.1038/nri.2016.68
Boussiotis, V. A. (2014). Somatic mutations and immunotherapy outcome with CTLA-4 blockade in melanoma. N. Engl. J. Med. 371, 2230–2232. doi: 10.1056/NEJMe1413061
Brahmer, J. R., and Pardoll, D. M. (2013). Immune checkpoint inhibitors: making immunotherapy a reality for the treatment of lung cancer. Cancer Immunol. Res. 1, 85–91. doi: 10.1158/2326-6066.CIR-13-0078
Brunet, J. F., Denizot, F., Luciani, M. F., Roux-Dosseto, M., Suzan, M., Mattei, M. G., et al. (1987). A new member of the immunoglobulin superfamily–CTLA-4. Nature 328, 267–270. doi: 10.1038/328267a0
Carson, M. J., Doose, J. M., Melchior, B., Schmid, C. D., and Ploix, C. C. (2006). CNS immune privilege: hiding in plain sight. Immunol. Rev. 213, 48–65. doi: 10.1111/j.1600-065X.2006.00441.x
Chen, L., and Flies, D. B. (2013). Molecular mechanisms of T cell co-stimulation and co-inhibition. Nat. Rev. Immunol. 13, 227–242. doi: 10.1038/nri3405
Chinot, O. L., Wick, W., Mason, W., Henriksson, R., Saran, F., Nishikawa, R., et al. (2014). Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N. Engl. J. Med. 370, 709–722. doi: 10.1056/NEJMoa1308345
Claes, A., Idema, A. J., and Wesseling, P. (2007). Diffuse glioma growth: a guerilla war. Acta Neuropathol. 114, 443–458. doi: 10.1007/s00401-007-0293-7
Cserr, H. F., Harling-Berg, C. J., and Knopf, P. M. (1992). Drainage of brain extracellular fluid into blood and deep cervical lymph and its immunological significance. Brain Pathol. 2, 269–276. doi: 10.1111/j.1750-3639.1992.tb00703.x
Danlos, F. X., Pages, C., Roux, J., Jebali, M., Gornet, J. M., Bagot, M., et al. (2015). Atypical severe immune-related adverse effects resulting from sequenced immunotherapy in melanoma. Melanoma Res. 25, 178–179. doi: 10.1097/CMR.0000000000000132
De Vries, J., and Figdor, C. (2016). Immunotherapy: Cancer vaccine triggers antiviral-type defences. Nature 534, 329–331. doi: 10.1038/nature18443
Delconte, R. B., Kolesnik, T. B., Dagley, L. F., Rautela, J., Shi, W., Putz, E. M., et al. (2016). CIS is a potent checkpoint in NK cell-mediated tumor immunity. Nat. Immunol. 17, 816–824. doi: 10.1038/ni.3470
Deng, R., Cassady, K., Li, X., Yao, S., Zhang, M., Racine, J., et al. (2015). B7H1/CD80 interaction augments PD-1-dependent T cell apoptosis and ameliorates graft-versus-host disease. J. Immunol. 194, 560–574. doi: 10.4049/jimmunol.1402157
Derer, A., Spiljar, M., Baumler, M., Hecht, M., Fietkau, R., Frey, B., et al. (2016). Chemoradiation Increases PD-L1 Expression in Certain Melanoma and Glioblastoma Cells. Front. Immunol. 7:610. doi: 10.3389/fimmu.2016.00610
Ding, Z. C., Lu, X., Yu, M., Lemos, H., Huang, L., Chandler, P., et al. (2014). Immunosuppressive myeloid cells induced by chemotherapy attenuate antitumor CD4+ T-cell responses through the PD-1-PD-L1 axis. Cancer Res. 74, 3441–3453. doi: 10.1158/0008-5472.CAN-13-3596
Domingues, D., Turner, A., Silva, M. D., Marques, D. S., Mellidez, J. C., Wannesson, L., et al. (2014). Immunotherapy and lung cancer: current developments and novel targeted therapies. Immunotherapy 6, 1221–1235. doi: 10.2217/imt.14.82
Dong, H., Strome, S. E., Salomao, D. R., Tamura, H., Hirano, F., Flies, D. B., et al. (2002). Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat. Med. 8, 793–800. doi: 10.1038/nm0902-1039c
Dong, H., Zhu, G., Tamada, K., and Chen, L. (1999). B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion. Nat. Med. 5, 1365–1369. doi: 10.1038/70932
Dovedi, S. J., Adlard, A. L., Lipowska-Bhalla, G., McKenna, C., Jones, S., Cheadle, E. J., et al. (2014). Acquired resistance to fractionated radiotherapy can be overcome by concurrent PD-L1 blockade. Cancer Res. 74, 5458–5468. doi: 10.1158/0008-5472.CAN-14-1258
Driessens, G., Kline, J., and Gajewski, T. F. (2009). Costimulatory and coinhibitory receptors in anti-tumor immunity. Immunol. Rev. 229, 126–144. doi: 10.1111/j.1600-065X.2009.00771.x
Durham, N. M., Nirschl, C. J., Jackson, C. M., Elias, J., Kochel, C. M., Anders, R. A., et al. (2014). Lymphocyte Activation Gene 3 (LAG-3) modulates the ability of CD4 T-cells to be suppressed in vivo. PLoS ONE 9:e109080. doi: 10.1371/journal.pone.0109080
Eisenhauer, E. A., Therasse, P., Bogaerts, J., Schwartz, L. H., Sargent, D., Ford, R., et al. (2009). New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur. J. Cancer 45, 228–247. doi: 10.1016/j.ejca.2008.10.026
Frey, B., Rubner, Y., Wunderlich, R., Weiss, E. M., Pockley, A. G., Fietkau, R., et al. (2012). Induction of abscopal anti-tumor immunity and immunogenic tumor cell death by ionizing irradiation - implications for cancer therapies. Curr. Med. Chem. 19, 1751–1764. doi: 10.2174/092986712800099811
Gedeon, P. C., Riccione, K. A., Fecci, P. E., and Sampson, J. H. (2014). Antibody-based immunotherapy for malignant glioma. Semin. Oncol. 41, 496–510. doi: 10.1053/j.seminoncol.2014.06.004
Gibney, G. T., Kudchadkar, R. R., Deconti, R. C., Thebeau, M. S., Czupryn, M. P., Tetteh, L., et al. (2015). Safety, correlative markers, and clinical results of adjuvant nivolumab in combination with vaccine in resected high-risk metastatic melanoma. Clin. Cancer Res. 21, 712–720. doi: 10.1158/1078-0432.CCR-14-2468
Graeber, M. B., Scheithauer, B. W., and Kreutzberg, G. W. (2002). Microglia in brain tumors. Glia 40, 252–259. doi: 10.1002/glia.10147
Gryaznova, Y., Koca Caydasi, A., Malengo, G., Sourjik, V., and Pereira, G. (2016). A FRET-based study reveals site-specific regulation of spindle position checkpoint proteins at yeast centrosomes. Elife 5:e14029. doi: 10.7554/eLife.14029
Hamid, O., Robert, C., Daud, A., Hodi, F. S., Hwu, W. J., Kefford, R., et al. (2013). Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N. Engl. J. Med. 369, 134–144. doi: 10.1056/NEJMoa1305133
Harshman, L. C., Drake, C. G., and Choueiri, T. K. (2014). PD-1 blockade in renal cell carcinoma: to equilibrium and beyond. Cancer Immunol. Res. 2, 1132–1141. doi: 10.1158/2326-6066.CIR-14-0193
Harshyne, L. A., Hooper, K. M., Andrews, E. G., Nasca, B. J., Kenyon, L. C., Andrews, D. W., et al. (2015). Glioblastoma exosomes and IGF-1R/AS-ODN are immunogenic stimuli in a translational research immunotherapy paradigm. Cancer Immunol. Immunother. 64, 299–309. doi: 10.1007/s00262-014-1622-z
Hassel, J. C. (2016). Ipilimumab plus nivolumab for advanced melanoma. Lancet Oncol. 17, 1471–1472. doi: 10.1016/S1470-2045(16)30409-0
Hegi, M. E., Diserens, A. C., Gorlia, T., Hamou, M. F., De Tribolet, N., Weller, M., et al. (2005). MGMT gene silencing and benefit from temozolomide in glioblastoma. N. Engl. J. Med. 352, 997–1003. doi: 10.1056/NEJMoa043331
Heppt, M. V., Eigentler, T. K., Kähler, K. C., Herbst, R. A., Göppner, D., Gambichler, T., et al. (2016). Immune checkpoint blockade with concurrent electrochemotherapy in advanced melanoma: a retrospective multicenter analysis. Cancer Immunol. Immunother. 65, 951–959. doi: 10.1007/s00262-016-1856-z
Huang, R., Harmsen, S., Samii, J. M., Karabeber, H., Pitter, K. L., Holland, E. C., et al. (2016). High precision imaging of microscopic spread of glioblastoma with a targeted ultrasensitive SERRS molecular imaging probe. Theranostics 6, 1075–1084. doi: 10.7150/thno.13842
Hugo, W., Zaretsky, J. M., Sun, L., Song, C., Moreno, B. H., Hu-Lieskovan, S., et al. (2016). Genomic and transcriptomic features of response to anti-PD-1 therapy in metastatic Melanoma. Cell 165, 35–44. doi: 10.1016/j.cell.2016.02.065
Hutchinson, L. (2016). Immunotherapy: exploiting mismatch repair in GBM. Nat. Rev. Clin. Oncol. 13, 264–265. doi: 10.1038/nrclinonc.2016.56
Jackson, C. M., Lim, M., and Drake, C. G. (2014). Immunotherapy for brain cancer: recent progress and future promise. Clin. Cancer Res. 20, 3651–3659. doi: 10.1158/1078-0432.CCR-13-2057
Jacobs, J. F., Idema, A. J., Bol, K. F., Nierkens, S., Grauer, O. M., Wesseling, P., et al. (2009). Regulatory T cells and the PD-L1/PD-1 pathway mediate immune suppression in malignant human brain tumors. Neuro Oncol. 11, 394–402. doi: 10.1215/15228517-2008-104
Jiang, H., Hegde, S., Knolhoff, B. L., Zhu, Y., Herndon, J. M., Meyer, M. A., et al. (2016). Targeting focal adhesion kinase renders pancreatic cancers responsive to checkpoint immunotherapy. Nat. Med. 22, 851–860. doi: 10.1038/nm.4123
Kataoka, K., Takeuchi, H., Mizusawa, J., Ando, M., Tsubosa, Y., Koyanagi, K., et al. (2016). A randomized Phase III trial of thoracoscopic versus open esophagectomy for thoracic esophageal cancer: Japan Clinical Oncology Group Study JCOG1409. Jpn. J. Clin. Oncol. 46, 174–177. doi: 10.1093/jjco/hyv178
Konstantinou, M.-P., Dutriaux, C., Gaudy-Marqueste, C., Mortier, L., Bedane, C., Girard, C., et al. (2014). Ipilimumab in melanoma patients with brain metastasis: a retro-spective multicentre evaluation of thirty-eight patients. Acta Derm. Venereol. 94, 45–49. doi: 10.2340/00015555-1654
Kopecky, J., Kubecek, O., Trojanova, P., Kubala, E., and Kopecky, O. (2014). [Adverse effects of modern treatment of malignant melanoma and their treatment/ management]. Klin. Onkol. 27, 393–400. doi: 10.14735/amko2014393
Kourie, H. R., and Klastersky, J. (2016). Immune checkpoint inhibitors side effects and management. Immunotherapy 8, 799–807. doi: 10.2217/imt-2016-0029
Kranz, L. M., Diken, M., Haas, H., Kreiter, S., Loquai, C., Reuter, K. C., et al. (2016). Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature 534, 396–401. doi: 10.1038/nature18300
Kuehn, H. S., Ouyang, W., Lo, B., Deenick, E. K., Niemela, J. E., Avery, D. T., et al. (2014). Immune dysregulation in human subjects with heterozygous germline mutations in CTLA4. Science 345, 1623–1627. doi: 10.1126/science.1255904
Kyi, C., and Postow, M. A. (2014). Checkpoint blocking antibodies in cancer immunotherapy. FEBS Lett. 588, 368–376. doi: 10.1016/j.febslet.2013.10.015
Lancaster, M. A., Renner, M., Martin, C. A., Wenzel, D., Bicknell, L. S., Hurles, M. E., et al. (2013). Cerebral organoids model human brain development and microcephaly. Nature 501, 373–379. doi: 10.1038/nature12517
Larkin, J., Hodi, F. S., and Wolchok, J. D. (2015). Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N. Engl. J. Med. 373, 1270–1271. doi: 10.1056/NEJMoa1504030
Lesterhuis, W. J., Salmons, J., Nowak, A. K., Rozali, E. N., Khong, A., Dick, I. M., et al. (2013). Synergistic effect of CTLA-4 blockade and cancer chemotherapy in the induction of anti-tumor immunity. PLoS ONE 8:e61895. doi: 10.1371/journal.pone.0061895
Linsley, P. S., Greene, J. L., Brady, W., Bajorath, J., Ledbetter, J. A., and Peach, R. (1994). Human B7-1 (CD80) and B7-2 (CD86) bind with similar avidities but distinct kinetics to CD28 and CTLA-4 receptors. Immunity 1, 793–801. doi: 10.1016/S1074-7613(94)80021-9
Liu, F., Huang, J., Ning, B., Liu, Z., Chen, S., and Zhao, W. (2016). Drug discovery via human-derived stem cell organoids. Front. Pharmacol. 7:334. doi: 10.3389/fphar.2016.00334
Liu, Y., and Zeng, G. (2012). Cancer and innate immune system interactions: translational potentials for cancer immunotherapy. J. Immunother. 35, 299–308. doi: 10.1097/CJI.0b013e3182518e83
Louveau, A., Smirnov, I., Keyes, T. J., Eccles, J. D., Rouhani, S. J., Peske, J. D., et al. (2015). Structural and functional features of central nervous system lymphatic vessels. Nature 523, 337–341. doi: 10.1038/nature14432
Mao, H., Lebrun, D. G., Yang, J., Zhu, V. F., and Li, M. (2012). Deregulated signaling pathways in glioblastoma multiforme: molecular mechanisms and therapeutic targets. Cancer Invest. 30, 48–56. doi: 10.3109/07357907.2011.630050
Melero, I., and Lasarte, J. J. (2015). Genetic basis for clinical response to CTLA-4 blockade. N. Engl. J. Med. 372:783. doi: 10.1056/NEJMc1415938
Michot, J. M., Bigenwald, C., Champiat, S., Collins, M., Carbonnel, F., Postel-Vinay, S., et al. (2016). Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur. J. Cancer 54, 139–148. doi: 10.1016/j.ejca.2015.11.016
Motzer, R. J., Rini, B. I., McDermott, D. F., Redman, B. G., Kuzel, T. M., Harrison, M. R., et al. (2015). Nivolumab for metastatic renal cell carcinoma: results of a randomized phase II trial. J. Clin. Oncol. 33, 1430–1437. doi: 10.1200/JCO.2014.59.0703
Naidoo, J., Page, D. B., and Wolchok, J. D. (2014). Immune modulation for cancer therapy. Br. J. Cancer 111, 2214–2219. doi: 10.1038/bjc.2014.348
Nghiem, P. T., Bhatia, S., Lipson, E. J., Kudchadkar, R. R., Miller, N. J., Annamalai, L., et al. (2016). PD-1 blockade with pembrolizumab in advanced merkel-cell carcinoma. N. Engl. J. Med. 374, 2542–2552. doi: 10.1056/NEJMoa1603702
Nishino, M., Sholl, L. M., Hodi, F. S., Hatabu, H., and Ramaiya, N. H. (2015). Anti-PD-1-Related Pneumonitis during Cancer Immunotherapy. N. Engl. J. Med. 373, 288–290. doi: 10.1056/NEJMc1505197
Ohtsuki, S., and Terasaki, T. (2007). Contribution of carrier-mediated transport systems to the blood-brain barrier as a supporting and protecting interface for the brain; importance for CNS drug discovery and development. Pharm. Res. 24, 1745–1758. doi: 10.1007/s11095-007-9374-5
Park, B., Yee, C., and Lee, K. M. (2014). The effect of radiation on the immune response to cancers. Int. J. Mol. Sci. 15, 927–943. doi: 10.3390/ijms15010927
Pegram, H. J., Andrews, D. M., Smyth, M. J., Darcy, P. K., and Kershaw, M. H. (2011). Activating and inhibitory receptors of natural killer cells. Immunol. Cell Biol. 89, 216–224. doi: 10.1038/icb.2010.78
Pilones, K. A., Vanpouille-Box, C., and Demaria, S. (2015). Combination of radiotherapy and immune checkpoint inhibitors. Semin. Radiat. Oncol. 25, 28–33. doi: 10.1016/j.semradonc.2014.07.004
Purwada, A., Jaiswal, M. K., Ahn, H., Nojima, T., Kitamura, D., Gaharwar, A. K., et al. (2015). Ex vivo engineered immune organoids for controlled germinal center reactions. Biomaterials 63, 24–34. doi: 10.1016/j.biomaterials.2015.06.002
Razavi, S. M., Lee, K. E., Jin, B. E., Aujla, P. S., Gholamin, S., and Li, G. (2016). Immune evasion strategies of glioblastoma. Front. Surg. 3:11. doi: 10.3389/fsurg.2016.00011
Reardon, D. A., Freeman, G., Wu, C., Chiocca, E. A., Wucherpfennig, K. W., Wen, P. Y., et al. (2014). Immunotherapy advances for glioblastoma. Neuro Oncol. 16, 1441–1458. doi: 10.1093/neuonc/nou212
Reinherz, E. L., and Schlossman, S. F. (1980). Current concepts in immunology: regulation of the immune response–inducer and suppressor T-lymphocyte subsets in human beings. N. Engl. J. Med. 303, 370–373. doi: 10.1056/NEJM198008143030704
Rexer, H. (2015). [Therapy of untreated local advanced or metastatic renal cell carcinoma. Phase III, randomized, open-label study of nivolumab combined with ipilimumab versus sunitinib monotherapy in subjects with previously untreated, local advanced or metastatic renal cell carcinoma (CheckMate 214 - AN 36/15 of the AUO)]. Urologe A 54, 1443–1445. doi: 10.1007/s00120-015-3946-5
Rizvi, N. A., Mazieres, J., Planchard, D., Stinchcombe, T. E., Dy, G. K., Antonia, S. J., et al. (2015). Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial. Lancet Oncol. 16, 257–265. doi: 10.1016/S1470-2045(15)70054-9
Robert, C., Long, G. V., Brady, B., Dutriaux, C., Maio, M., Mortier, L., et al. (2015). Nivolumab in previously untreated melanoma without BRAF mutation. N. Engl. J. Med. 372, 320–330. doi: 10.1056/NEJMoa1412082
Roopenian, D. C., and Akilesh, S. (2007). FcRn: the neonatal Fc receptor comes of age. Nat. Rev. Immunol. 7, 715–725. doi: 10.1038/nri2155
Rosell, R., and Karachaliou, N. (2016). Trends in immunotherapy for brain metastases. Lancet Oncol. 17, 859–860. doi: 10.1016/S1470-2045(16)30091-2
Roth, P., Preusser, M., and Weller, M. (2016). Immunotherapy of brain cancer. Oncol. Res. Treat. 39, 326–334. doi: 10.1159/000446338
Sakai, K., Shimodaira, S., Maejima, S., Udagawa, N., Sano, K., Higuchi, Y., et al. (2015). Dendritic cell-based immunotherapy targeting Wilms' tumor 1 in patients with recurrent malignant glioma. J. Neurosurg. 123, 989–997. doi: 10.3171/2015.1.JNS141554
Shao, R.-G., Cao, C.-X., and Pommier, Y. (2004). Abrogation of Chk1-mediated S/G2 checkpoint by UCN-01 enhances ara-C-induced cytotoxicity in human colon cancer cells. Acta Pharmacol. Sin. 25, 756–762.
Sharon, E., Streicher, H., Goncalves, P., and Chen, H. X. (2014). Immune checkpoint inhibitors in clinical trials. Chin. J. Cancer 33, 434–444. doi: 10.5732/cjc.014.10122
Silk, A. W., Bassetti, M. F., West, B. T., Tsien, C. I., and Lao, C. D. (2013). Ipilimumab and radiation therapy for melanoma brain metastases. Cancer Med. 2, 899–906. doi: 10.1002/cam4.140
Stupp, R., Mason, W. P., Van Den Bent, M. J., Weller, M., Fisher, B., Taphoorn, M. J., et al. (2005). Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N. Engl. J. Med. 352, 987–996. doi: 10.1056/NEJMoa043330
Suryadevara, C. M., Verla, T., Sanchez-Perez, L., Reap, E. A., Choi, B. D., Fecci, P. E., et al. (2015). Immunotherapy for malignant glioma. Surg. Neurol. Int. 6, S68–77. doi: 10.4103/2152-7806.151341
Sznol, M., and Longo, D. L. (2015). Release the hounds! Activating the T-cell response to cancer. N. Engl. J. Med. 372, 374–375. doi: 10.1056/NEJMe1413488
Takita, M., Matsumura, T., and Kami, M. (2006). Cytokine storm and an anti-CD28 monoclonal antibody. N. Engl. J. Med. 355, 2591–2594. doi: 10.1056/NEJMc062750
Tang, A., Judge, T. A., Nickoloff, B. J., and Turka, L. A. (1996). Suppression of murine allergic contact dermatitis by CTLA4Ig. Tolerance induction of Th2 responses requires additional blockade of CD40-ligand. J. Immunol. 157, 117–125.
Taube, J. M., Klein, A., Brahmer, J. R., Xu, H., Pan, X., Kim, J. H., et al. (2014). Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy. Clin. Cancer Res. 20, 5064–5074. doi: 10.1158/1078-0432.CCR-13-3271
Thomas, R. P., Xu, L. W., Lober, R. M., Li, G., and Nagpal, S. (2013). The incidence and significance of multiple lesions in glioblastoma. J. Neurooncol. 112, 91–97. doi: 10.1007/s11060-012-1030-1
Topalian, S. L., Hodi, F. S., Brahmer, J. R., Gettinger, S. N., Smith, D. C., McDermott, D. F., et al. (2012). Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N. Engl. J. Med. 366, 2443–2454. doi: 10.1056/NEJMoa1200690
Topalian, S. L., and Sharpe, A. H. (2014). Balance and imbalance in the immune system: life on the edge. Immunity 41, 682–684. doi: 10.1016/j.immuni.2014.11.005
Topalian, S. L., Sznol, M., McDermott, D. F., Kluger, H. M., Carvajal, R. D., Sharfman, W. H., et al. (2014). Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J. Clin. Oncol. 32, 1020–1030. doi: 10.1200/JCO.2013.53.0105
van Dam, L. S., De Zwart, V. M., and Meyer-Wentrup, F. A. (2014). The role of programmed cell death-1 (PD-1) and its ligands in pediatric cancer. Pediatr. Blood Cancer 62, 190–197. doi: 10.1002/pbc.25284
Vetizou, M., Pitt, J. M., Daillere, R., Lepage, P., Waldschmitt, N., Flament, C., et al. (2015). Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science 350, 1079–1084. doi: 10.1126/science.aad1329
Vlahovic, G., Fecci, P. E., Reardon, D., and Sampson, J. H. (2015). Programmed death ligand 1 (PD-L1) as an immunotherapy target in patients with glioblastoma. Neuro Oncol. 17, 1043–1045. doi: 10.1093/neuonc/nov071
Wainwright, D. A., Chang, A. L., Dey, M., Balyasnikova, I. V., Kim, C. K., Tobias, A., et al. (2014). Durable therapeutic efficacy utilizing combinatorial blockade against IDO, CTLA-4, and PD-L1 in mice with brain tumors. Clin. Cancer Res. 20, 5290–5301. doi: 10.1158/1078-0432.CCR-14-0514
Wang, C., Thudium, K. B., Han, M., Wang, X. T., Huang, H., Feingersh, D., et al. (2014). In vitro characterization of the anti-PD-1 antibody nivolumab, BMS-936558, and in vivo toxicology in non-human primates. Cancer Immunol. Res. 2, 846–856. doi: 10.1158/2326-6066.CIR-14-0040
Weller, M., Van Den Bent, M., Hopkins, K., Tonn, J. C., Stupp, R., Falini, A., et al. (2014). EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol. 15, e395–e403. doi: 10.1016/S1470-2045(14)70011-7
Wolchok, J. D., Hoos, A., O'day, S., Weber, J. S., Hamid, O., Lebbe, C., et al. (2009). Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin. Cancer Res. 15, 7412–7420. doi: 10.1158/1078-0432.CCR-09-1624
Wolchok, J. D., Kluger, H., Callahan, M. K., Postow, M. A., Rizvi, N. A., Lesokhin, A. M., et al. (2013). Nivolumab plus ipilimumab in advanced melanoma. N. Engl. J. Med. 369, 122–133. doi: 10.1056/NEJMoa1302369
Zang, X., and Allison, J. P. (2007). The B7 family and cancer therapy: costimulation and coinhibition. Clin. Cancer Res. 13, 5271–5279. doi: 10.1158/1078-0432.CCR-07-1030
Zeng, J., See, A. P., Phallen, J., Jackson, C. M., Belcaid, Z., Ruzevick, J., et al. (2013). Anti-PD-1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas. Int. J. Radiat. Oncol. Biol. Phys. 86, 343–349. doi: 10.1016/j.ijrobp.2012.12.025
Gerelateerde artikelen
- CAR-T celtherapie maakt dat kinderen met neuroblastoma nu in 2025 al meer dan 10 jaar kankervrij zijn. Met uitgelicht een prachtig overlevingsverhaal van een kind van 4 jaar die anno 2025 al 19 jaar kankervrij is. copy 1
- Immuuntherapie met specifieke CAR-T cel behandeling (GD2-CAR T cel behandeling) blijkt ook effectief bij kinderen en jong volwassen patienten met een hersentumor.
- CAR-T celtherapie rechtstreeks toegediend in de hersenen doet tumorweefsel van Glioblastoma Multiforma snel slinken en soms zelfs verdwijnen.
- Gepersonaliseerde vorm van immuuntherapie succesvol bij melanomen gegeven voor operatie doet hersentumor type Glioblastoma Multiforme van arts verdwijnen en er is nog geen teken van recidief na 1 jaar.
- mRNA vaccin doet hersentumoren type Glioblastoma razendsnel veranderen van koude tumoren in warme tumoren. Blijkt uit eerste klinische studie bij volwassen patienten en bevestigt resultaten uit dierstudies
- DCVax-L verbetert overall overleving en vermindert kans op recidief bij patiënten met nieuw gediagnosticeerd glioblastoom en recidiverend glioblastoom in vergelijking met beste standaardzorg
- Craniopharyngiomas, goedaardige inoperabele primaire hersentumoren van de hypofyse-hypothalamus-as met BRAF V600E mutaties reageren bijzonder goed op combinatiebehandeling van vemurafenib + cobimetinib
- Immuuntherapie met Natural Killer cellen en opgekweekte versterkte autologe T-cellen geeft verrassend goede resultaten bij patienten met een recidief van een hersentumor type glioblastoom multiforme
- Immuuntherapie met cocktail van 9 niet-toxische medicijnen - middelen bij hersentumoren van het type Glioblastoma Multiforme blijkt veilig en geeft veelbelovende resultaten bij eerste 9 patienten uit studie van prof. dr. Halatsch
- Lage tumor mutatie belasting geeft een langere overleving bij patienten met een recidief van een glioblastoom wanneer deze behandeld zijn met immuuntherapie met een gemoduleerd poliovirus of anti-PD medicijn
- Meisje van drie jaar komt en blijft in een complete remissie van een hersentumor glioblastoma met larotrectinib een zogeheten TRK medicijn op basis van haar ETV6–NTRK3 mutatie. copy 1
- Surviving terminal cancer: kunnen overlevenden van een hersentumor helpen kanker te overwinnen? Drie mannen overwonnen hun hersentumor - GBM - en 2 ervan zijn al 15 en 20 jaar vrij van kanker met eigen cocktail van bewezen niet-toxische middelen. copy 1 c
- Immuuntherapie met anti-PD medicijnen (pembrolizumab en / of nivolumab) geeft geen effect op overall overleving bij zwaar voorbehandelde patienten met glioblastoma multiforme
- Immuuntherapie met gemoduleerd poliovirus blijkt succesvol bij recidief van hersentumoren van het type glioblastoma multiforme graad IV
- Inovio Pharmaceuticals Initiates Immuno-Oncology Clinical Study for Glioblastoma in Combination with Regeneron’s PD-1 Inhibitor
- immuuntherapie met rindopepimut een vaccin (gericht op EGFR mutatie) naast temozolomide geeft geen enkel verschil in overall overleving in vergelijking met alleen temozolomide bij hersentumoren Glioblastoma met weinig of geen restweefsel na operatie
- Immuuntherapie met dendritische celtherapie voor hersentumoren type glioblastoma multiforme geeft 20 en 14 procent overall overleving versus 4 en 0 procent op 3 en 5 jaar .
- Dendritische celtherapie bij glioblastoma multiforme graad IV direct na bestraling plus temodal geeft langere overall overleving. 46 procent leeft nog na 3 jaar
- Nivolumab faalt bij recidief van een hersentumor Glioblastoma multiforme. Fase III studie Checkmate 143 wordt stopgezet
- Immuuntherapie met specifiek geprepareerde dendritische cellen (APVACS) plus tetanus virus (CMV) geeft superieure duurzame resultaten op ziektevrije tijd en overall overleving
- Immuuntherapie met gemoduleerd herpesvirus - AdV-Tk therapy - na operatie zorgt voor hoog significant meer en langere overleving in vergelijking met standaardbehandeling bij hersentumoren Glioblastoma multiforme
- APVACS - actief gepersonaliseerde vaccins - ontwikkelen tegen kanker wordt doel van nieuw consortium van 14 organisaties - GAPVAC, waaronder LUMC Leiden
- Toca 511 & Toca FC, een vorm van immuuntherapie met een gemodificeerd virus in combinatie met 5-FU bij hersentumoren - glioblastoma multiforme, heeft de eerste patiënt in behandeling genomen
- Dendritische celtherapie gecombineerd met een vaccin gericht op CD-133 eiwitexpressie voor patiënten met een hersentumor glioblastoma multiforme wordt in fase I/II studie onderzocht
- Behandeling met een virus - Delta-24-RDG - voor hersentumoren - glioblastoma multiforme wordt onderzocht in een fase I /II studie in het VUmc - Amsterdam
- Dendritische celtherapie gecombineerd met zogeheten mRNA's - cellen uit tumoren - verdriedubbeld overlevingstijd van mensen met een hersentumor - glioblastoma multiforme. copy 1
- Vaccin gemaakt van eigen tumorweefsel (HSPPC-96) verlengt leven 2 tot 3 keer zo lang van mensen met een geheel of gedeeltelijke operabele hersentumor. Dit.blijkt uit tussenevaluatie van fase II studie gepresenteerd op ASCO 2011
- Dendritische celtherapie met autoloog vaccin gebaseerd op antigenen geeft significant langere ziektevrije tijd en overall overleving bij patiënten met een hersentumor - glioblastoom
- Dendritische celtherapie vooral ook succesvol toepasbaar bij hersentumoren
- Immuuntherapie bij hersentumoren: Dendritische cellen toegediend na operatie van hersentumoren zorgt voor opmerkelijk goede kansen op geen recidief aldus resultaten uit kleinschalige studie bij 23 patiënten.
- Immuuntherapie bij hersentumoren: Dendritische cellen toegediend na operatie van hersentumoren zorgt voor opmerkelijk goede kansen op geen recidief aldus resultaten uit kleinschalige studie bij 12 patiënten.
- Immuuntherapie met synthetisch vaccin brengt enkele kinderen met een hersentumor - glioblastoom in een totale remissie
- Vaccin dat hersentumoren (Glioblastoom multiforme) met EGFRvIII expressie bestrijdt geeft verdubbeling van overlevingstijd en progressievrije tijd bij nieuw gediagnosteerde patienten
- Neuroblastomen: Immuuntherapie met chimeric anti-GD2 antibody ch 14.18 verhoogt significant overall overleving na 2 jaar met 20% t.o.v. alleen chemotherapie plus stamceltherapie.
- Stamcellen uit eigen bloed naast zware chemokuren geeft kinderen met recidief van hersentumoren langere overlevingstijd en kans op totale genezing, maar ook overlijdt 1 op de 4 kinderen aan de gevolgen van de behandeling
- Virussen: Herpes virusachtig medicijn - G207 wordt in fase I trial onderzocht bij kwaadaardige Glioma tumoren waarvoor radiotherapie - bestraling of chemo niet meer werkt en dus uitbehandeld zijn.
- Immuuntherapie bij hersentumoren met vaccins en virussen waaronder Newcastle Disease Virus. Een overzicht van recente ontwikkelingen.



Plaats een reactie ...
Reageer op "Immuuntherapie met anti-PD medicijnen (pembrolizumab en / of nivolumab) geeft geen effect op overall overleving bij zwaar voorbehandelde patienten met glioblastoma multiforme"