23 augustus 2019: zie ook dit artikel:
https://kanker-actueel.nl/immuuntherapie-met-gemanipuleerde-t-cellen-car-t-celtherapie-tisagenlecleucel-geeft-spectaculair-goede-resultaten-bij-patienten-met-gevorderde-lymfklierkanker-non-hodgkin-b-lymfomen.html
19 mei 2018: Zie verder hieronder, ook het verhaal van IVO, een Nederlandse patient uit die studie
https://kanker-actueel.nl/ivo-visser-uitbehandeld-voor-zeldzame-vorm-van-lymfklierkanker-komt-alsnog-in-total-remissie-kankervrij-met-t-car-cel-immuuntherapie.html
31 augustus 2017: Lees ook dit artikel:
https://kanker-actueel.nl/NL/immuuntherapie-met-car-t-cell-therapy-tisagenlecleucel-kymriah-goedgekeurd-door-fda-voor-gebruik-bij-kinderen-en-jong-volwassenen-met-vorm-van-acute-lymfatische-leukemie-all.html
7 november 2015: lees het verhaal van Layla, een baby nog geen jaar oud die via immuuntherapie met T-cellen van een donor, T-cell enginering geheten, toegepast vlak voordat ze zou sterven, alsnog in een totale remissie kwam en nu al ruim dire maanden kankervrij is. Het verhaal van Layla met All - Acute Lymfatische Leukemie is wereldwijd overal gepubliceerd maar lees hier hoe de Volkskrant en Nature erover schrijven:
https://kanker-actueel.nl/NL/layla-een-baby-met-ongeneeslijke-vorm-van-all-acute-lymfatische-leukemie-lijkt-alsnog-te-genezen-door-immuuntherapie-met-t-cellen-van-een-donor-via-t-cell-enginering-therapie.html
27 december 2017: Op het jaarlijkse symposium van de ASH 2017 zijn nieuwe resultaten gepresenteerd van immuuntherapie met CAR-T cellen, de zogeheten Axicabtagene Ciloleucel CAR T-Cell Therapy aanpak. Met nog meer duurzame complete remissies dan vorig jaar. Hele mooie resultaten dus. Aan deze studies kunnen ook Nederlandse patiënten meedoen via o.a. UMCG blijkt uit een persbericht afgelopen week op NU.nl. UMC Groningen past nieuwe therapie voor patiënt met lymfeklierkanker toe
Dit zijn de twee nieuwe publicaties:
1. Neelapu SS, Locke FL, Bartlett NL, et al: Long-term follow-up ZUMA-1: A pivotal trial of axicabtagene ciloleucel in patients with refractory aggressive non-Hodgkin lymphoma. 2017 ASH Annual Meeting. Abstract 578. Presented December 11, 2017.
2. Neelapu SS, Locke FL, Bartlett NL, et al: Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med. December 10, 2017 (early release online).
Zie verder hieronder een beschrijving van deze aanpak.
2 december 2016: lees ook dit artikel:
https://kanker-actueel.nl/NL/pembrolizumab-geeft-zeer-goede-resultaten-65-procent-respons-bij-klassieke-lymfklierkanker-hodgkin-bij-zwaar-voorbehandelde-patienten-en-na-falen-van-oa-brentuximab-plus-vedotin.html
6 september 2016: Bron: 1. Maloney DG: CAR-T cells in treating lymphoma. 2016 Pan Pacific Lymphoma Conference. Presented July 21, 2016.
Immuuntherapie met extra op bepaalde genenmutaties gemoduleerde T-CAR cells (Chimeric Antigen Receptor (CAR) T-cell therapy) geeft bij patiënten met non-Hodgkin een vorm van lymfklierkanker en patienten met vormen van leukemie met zogeheten kwaadaardige B-cellen alsnog bijzonder goede resultaten.Dit blijkt uit een evaluatie van T-car cell onderzoek dat wordt gedaan door David G. Maloney, MD, PhD, Professor of Medicine at the University of Washington and Member of the Clinical Research Division, Fred Hutchinson Cancer Research Center.
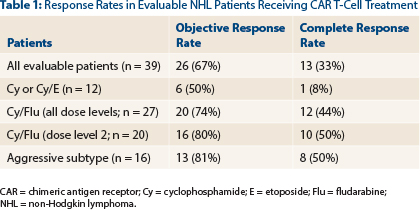
Van de 41 behandelde patienten met non-Hodgkin bereikte alsnog 13 patiënten (33%) een complete remissie en 26 patiënten (67%) reageerden goed op deze behandeling met een respons van minimaal een gedeeltelijke remissie (PR = minimaal 50% vermindering van tumorvolume en/of omvang). Wanneer de gemoduleerde T-car cells werden gecombineerd met vooraf een chemo combinatie van cyclophosphamide/fludarabine steeg de respons naar 80% met 50% complete remissies.
Hier in schema de patienten met non-Hdogkin en wat zij kregen:
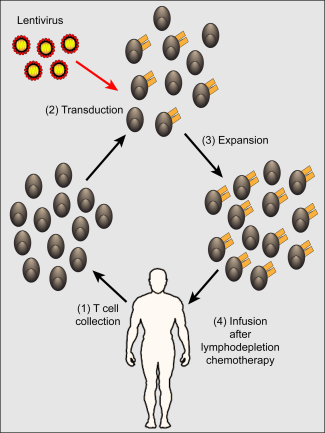
Hier een schematische afbeelding hoe gemoduleerde T-car cells precies werken gehaald uit een volledig studierapport van de hand van de hoofdonderzoeker Dr. Maloney:
dat de T-car cell therapie bij verschillende vormen van kanker omschrijft en analyseert:
Ik vind het te ingewikkeld om alles in goed Nederlands te vertalen maar dit zijn de kernpunten uit de studie
T-car Cells voor Lymfklierkanker - non-Hodgkin
- Onderzoekers aan het Fred Hutchinson Cancer Research Center hebben een gemoduleerd CAR T-cell product geconstrueerd met een gelijke mix van CD8-positieve en CD4-positieve– afgeleide CAR T cells; deze compositie geeft een optimale potentie in een pre-klinische studie.
- Protocol 2639 heeft 125 patienten met B-cell malignancies geworden, en voor de 39 evalueerbare patiënten met non-Hodgkin lymfklierkanker, de response rate op de CAR T-cell therapie was 67%, met 33% complete remissies - CR.
- Bij patienten die het optimale behandelingsregiem voor lymfklierkanker kregen (cyclophosphamide/fludarabine) met een optimale dosis de response cijffers verbeterden naar 80% met 50% complete remissies - CT.
In een artikel in ASCO post over deze studie is een video te zien waarin dr. Maloney verder uitleg geeft hoe zij werken met gemoduleerde T-car cell therapie.
Het abstract van bovengenoemde studie met referentielijst:
Protocol 2639 has enrolled 125 patients with B-cell malignancies, and for 39 evaluable patients with non-Hodgkin lymphoma, the response rate to CAR T-cell therapy was 67%, with a 33% rate of complete responses.
D19-Targeted chimeric antigen receptor-modified T-cell immunotherapy for B-cell malignancies
Abstract
Chimeric antigen receptors (CARs) comprise a tumor-targeting moiety, often in the form of a single chain variable fragment derived from a monoclonal antibody, fused to one or more intracellular T-cell signaling sequences. Lymphodepletion chemotherapy followed by infusion of T cells that are genetically modified to express a CD19-specific CAR is a promising therapy for patients with refractory CD19+ B-cell malignancies, producing rates of complete remission that are remarkably high in acute lymphoblastic leukemia and encouraging in non-Hodgkin lymphoma and chronic lymphocytic leukemia. Responses are often durable, although additional studies are needed to define the role of CAR-T cell immunotherapy in the context of other treatments. CAR-modified T-cell immunotherapy can be complicated by cytokine release syndrome and neurologic toxicity, which in most cases are manageable and reversible. Here we review recent clinical trial data and discuss issues for the field.
CONCLUSION
CD19 CAR-T cell therapy has produced significant response rates in patients with refractory B-ALL, NHL, and CLL. While this approach is still in development, the high response rates and durability in many patients may herald a new era in cancer therapy. The toxicities of CAR-T cell immunotherapy, including CRS and neurologic symptoms and signs, are significant, but appear reversible for the most part with appropriate intervention with tocilizumab and/or corticosteroids. Identification of strategies to predict serious toxicity will facilitate studies of early intervention for toxicity and enhance future development of CAR-T cell therapeutics.
CONFLICT OF INTEREST
CT, SR, and DM receive research funding from Juno Therapeutics. CT and SR hold patents. SR is a cofounder of Juno Therapeutics. FHCRC receives research funding from Juno Therapeutics.
Ancillary
- 1 Stamenkovic, I. & Seed, B. CD19, the earliest differentiation antigen of the B cell lineage, bears three extracellular immunoglobulin-like domains and an Epstein-Barr virus-related cytoplasmic tail. J. Exp. Med. 168, 1205–1210 (1988).
- 2 Davila, M.L. et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. Sci. Transl. Med. 6, 224ra25 (2014).
- 3 Kochenderfer, J.N. et al. B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells. Blood 119, 2709–2720 (2012).
- 4 Lee, D.W. et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial. Lancet 385, 517–528 (2015).
- 5 Maude, S.L. et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. N. Engl. J. Med. 371, 1507–1517 (2014).
- 6 Porter, D.L. et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci. Transl. Med. 7, 303ra139 (2015).
- 7 Turtle CJ. Chimeric antigen receptor modified T cell therapy for B cell malignancies. Int. J. Hematol. 99, 132–140 (2014).
- 8 Savoldo, B. et al. CD28 costimulation improves expansion and persistence of chimeric antigen receptor-modified T cells in lymphoma patients. J. Clin. Invest. 121, 1822–1826 (2011).
- 9 Topp, M.S. et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Oncol. 16, 57–66 (2015).
- 10 Lee, D.W. et al. Current concepts in the diagnosis and management of cytokine release syndrome. Blood 124, 188–195 (2014).
- 11 Brentjens R.J., et al. CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Sci. Transl. Med. 5, 177ra38 (2013).
- 12 Brentjens, R.J. et al. Eradication of systemic B-cell tumors by genetically targeted human T lymphocytes co-stimulated by CD80 and interleukin-15. Nat. Med. 9, 279–286 (2003).
- 13 Sommermeyer, D. et al. Chimeric antigen receptor-modified T cells derived from defined CD8(+) and CD4(+) subsets confer superior antitumor reactivity in vivo. Leukemia 30, 492–500 (2016).
- 14 Turtle, C.J. & Riddell, S.R. Genetically retargeting CD8+ lymphocyte subsets for cancer immunotherapy. Curr. Opin. Immunol. 23, 299–305 (2011).
- 15 Turtle, C.J., Swanson, H.M., Fujii, N., Estey, E.H. & Riddell, S.R. A distinct subset of self-renewing human memory CD8+ T cells survives cytotoxic chemotherapy. Immunity 31, 834–844 (2009).
- 16 Terakura, S. et al. Generation of CD19-chimeric antigen receptor modified CD8+ T cells derived from virus-specific central memory T cells. Blood 119, 72–82 (2012).
- 17 Wang, X. et al. Engraftment of human central memory-derived effector CD8+ T cells in immunodeficient mice. Blood 117, 1888–1898 (2011).
- 18 Wang, X. et al. A transgene-encoded cell surface polypeptide for selection, in vivo tracking, and ablation of engineered cells. Blood 118, 1255–1263 (2011).
- 19 Brudno, J.N. et al. Allogeneic T cells that express an anti-CD19 chimeric antigen receptor induce remissions of B-cell malignancies that progress after allogeneic hematopoietic stem-cell transplantation without causing graft-versus-host disease. J. Clin. Oncol. 34, 1112–1121 (2016).
- 20 Kochenderfer, J.N. et al. Donor-derived CD19-targeted T cells cause regression of malignancy persisting after allogeneic hematopoietic stem cell transplantation. Blood 122, 4129–4139 (2013).
- 21 Kochenderfer, J.N. et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor. J. Clin. Oncol. 33, 540–549 (2015).
- 22 Porter, D.L., Levine, B.L., Kalos, M., Bagg, A. & June, C.H. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N. Engl. J. Med. 365, 725–733 (2011).
- 23 Grupp, S.A. et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N. Engl. J. Med. 368, 1509–1518 (2013).
- 24 Hodi, F.S. et al. Evaluation of immune-related response criteria and RECIST v1.1 in patients with advanced melanoma treated with pembrolizumab. J. Clin. Oncol. 34, 1510–1517 (2016).
- 25 Singh, N., Perazzelli, J., Grupp, S.A. Barrett, D.M. Early memory phenotypes drive T cell proliferation in patients with pediatric malignancies. Sci. Transl. Med. 8, 320ra3 (2016).
- 26 Cieri, N. et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors. Blood 121, 573–584 (2013).
- 27 Gattinoni, L. et al. A human memory T cell subset with stem cell-like properties. Nat. Med. 17, 1290–1297 (2011).
- 28 Hinrichs, C.S. et al. IL-2 and IL-21 confer opposing differentiation programs to CD8+ T cells for adoptive immunotherapy. Blood 111, 5326–5333 (2008).
- 29 Brentjens, R.J. et al. Genetically targeted T cells eradicate systemic acute lymphoblastic leukemia xenografts. Clin. Cancer Res. 13, 5426–5435 (2007).
- 30 Carpenito, C. et al. Control of large, established tumor xenografts with genetically retargeted human T cells containing CD28 and CD137 domains. Proc. Natl. Acad. Sci. U. S. A. 106, 3360–3365 (2009).
- 31 Hudecek, M. et al. Receptor affinity and extracellular domain modifications affect tumor recognition by ROR1-specific chimeric antigen receptor T cells. Clin. Cancer Res. 19, 3153–3164 (2013).
- 32 Hudecek, M. et al. The nonsignaling extracellular spacer domain of chimeric antigen receptors is decisive for in vivo antitumor activity. Cancer Immunol. Res. 3, 125–135 (2015).
- 33 James, S.E. et al. Antigen sensitivity of CD22-specific chimeric TCR is modulated by target epitope distance from the cell membrane. J. Immunol. 180, 7028–7038 (2008).
- 34 Zhao, Z. et al. Structural design of engineered costimulation determines tumor rejection kinetics and persistence of CAR T cells. Cancer Cell. 28, 415–428 (2015).
- 35 Moon, E.K. et al. Multifactorial T-cell hypofunction that is reversible can limit the efficacy of chimeric antigen receptor-transduced human T cells in solid tumors. Clin. Cancer Res. 20, 4262–4273 (2014).
- 36 Moon, E.K. et al. Blockade of programmed death 1 augments the ability of human T cells engineered to target NY-ESO-1 to control tumor growth after adoptive transfer. Clin. Cancer Res. 22, 436–447 (2016).
- 37 Ninomiya, S. et al. Tumor indoleamine 2,3-dioxygenase (IDO) inhibits CD19-CAR T cells and is downregulated by lymphodepleting drugs. Blood 125, 3905–3916 (2015).
- 38 Curran, K.J. et al. Enhancing antitumor efficacy of chimeric antigen receptor T cells through constitutive CD40L expression. Mol. Ther. 23, 769–778 (2015).
- 39 Pegram, H.J., et al. Tumor-targeted T cells modified to secrete IL-12 eradicate systemic tumors without need for prior conditioning. Blood 119, 4133–4141 (2012).
- 40 Pegram, H.J. et al. IL-12-secreting CD19-targeted cord blood-derived T cells for the immunotherapy of B-cell acute lymphoblastic leukemia. Leukemia 29, 415–422 (2015).
- 41 Gardner, R. et al. Acquisition of a CD19 negative myeloid phenotype allows immune escape of MLL-rearranged B-ALL from CD19 CAR-T cell therapy. Blood 2016; e-pub ahead of print.
- 42 Sotillo, E. et al. Convergence of acquired mutations and alternative splicing of CD19 enables resistance to CART-19 immunotherapy. Cancer Discov. 5, 1282–1295 (2015).
- 43 Haso, W. et al. Anti-CD22-chimeric antigen receptors targeting B-cell precursor acute lymphoblastic leukemia. Blood 121, 1165–1174 (2013).
CAR engineerd, CD19, immuuntherapie, Car-T-cellen, CD19, CD4, CD8, complete remissies, cyclophosphamide, fludarabine
Gerelateerde artikelen
- Tafasitamab - Monjuvi in combinatie met lenalidomide - Revlimid en R-CHOP geeft betere ziekteprogressievrije overleving in vergelijking met alleen R-CHOP bij patiënten met lymfklierkanker type diffuus grootcellig B-cellymfoom (Non-Hodgkin)
- loncastuximab tesirine en glofitamab combinatie geeft uitstekende resultaten met 89 procent ziektecontrole en 77 procent complete remissies bij patienten met uitgezaaide gevorderde B-cel non-Hodgkin-lymfoom
- CAR-T celtherapie - Axicabtagene ciloleucel geeft veel betere ziektevrije overleving in vergelijking met de standaardbehandeling van tweedelijnstherapie bij patiënten met recidief, ziekteprogressie van lymfklierkanker type diffuus grootcellig B-cellymfoom
- Immuuntherapie met nivolumab naast standaard chemo als eerstelijns behandeling zorgt voor betere resultaten en minder bijwerkingen bij patienten met klassieke ziekte van Hodgkin stadium III en IV in vergelijking met brentuximab vedotin
- Immuuntherapie met CAR-T celtherapie (isocabtagene maraleucel (liso-cel)) geeft meer complete remissies en betere overall overleving dan chemo + stamceltransplantatie als tweedelijnsbehandeling bij patienten met grootcellig B-cel lymfoom
- Autologe stamceltransplantatie plus anti-CD30 CAR-T celtherapie geeft 5 duurzame complete remissies bij 6 deelnemende patienten met lymfklierkanker die al paar keer een recidief hadden gehad ondanks chemokuren.
- Autologe stamceltransplantatie na immuuntherapie met anti-PD medicijnen geeft zeer goede resultaten voor gevorderde lymfklierkanker - Hodgkin lymfoom zelfs bij zwaar voorbehandelde patiënten
- Glofitamab, een antibody medicijn, alleen en in combinatie met obinutuzumab geeft nog goede respons (36 procdent) bij zwaar voorbehandelde patienten met recidief of refractair B-cel non-hodgkin-lymfoom.
- Mosunetuzumab, een bispecifiek monoklonaal antilichaam, geeft uitstekende resultaten (CR bij 60 procent) bij patienten met een Folliculair lymfoom waarbij eerdere behandelingen faalden.
- Pembrolizumab geeft langdurige complete en gedeeltelijke remissies (4 jaar en langer) bij zwaar voorbehandelde patiënten met klassiek Hodgkin-lymfoom na falen van brentuximab vedotin
- Immuuntherapie met Nivolumab solo of naast chemo (N-AVD) gevolgd door radiotherapie bij patiënten met hoog risico van lymfklierkanker als eerstelijns behandeling geeft uitstekende resultaten op korte termijn
- Bendamustine plus Rituximab gevolgd door behandelingen met 90-Yttrium plus 4x Ibritumomab Tiuxetan voor onbehandelde Folliculaire Lymfomen geeft betere overall overleving en langere duurzame ziektevrije tijd copy 1
- Immuuntherapie met Camrelizumab, een anti-PD medicijn geeft hele goede resultaten met complete en gedeeltelijke remissies bij patienten met recidief of ziekteprogressie van klassieke lymfklierkanker
- Immuuntherapie met gemanipuleerde T-cellen - CAR-T celtherapie ( tisagenlecleucel ) geeft spectaculair goede resultaten bij patienten met gevorderde lymfklierkanker - non-Hodgkin (B-lymfomen) copy 1
- Lenalidomide naast rituximab verbetert mediane progressievrije overleving met 25 maanden (39 vs 14 maanden) bij patienten met recidief van indolente lymfomen - lymfklierkanker, in vergelijking met alleen rituximab
- Ivo Visser uitbehandeld voor zeldzame vorm van lymfklierkanker komt alsnog in total remissie (kankervrij) met T-CAR cel immuuntherapie
- Immuuntherapie met extra gemoduleerde T-car cells geeft bij zwaar voorbehandelde lymfklierkanker non-Hodgkin alsnog uitstekende resultaten met 33 procent complete remissies
- Lymfklierkanker en leukemie kennen verschillende vormen en stadia. Hier een recente studie van de belangrijkste behandelingsopties, vooral met vormen van immuuntherapie
- Obinutuzumab aanvullend op standaard chemokuren, verlengt ziektevrije overall overleving (plus 34 procent) van indolente Non Hodgkin Lymphomen stadium III / IV in vergelijking met standaard chemo plus Rituximab.
- Pembrolizumab, immuuntherapie met een anti-PD medicijn, geeft uitstekende resultaten bij recidief of progressie van voorbehandelde patienten met lymfklierkanker, non-Hodgkin
- Pembrolizumab geeft zeer goede resultaten (65 procent respons) bij klassieke lymfklierkanker (Hodgkin) bij zwaar voorbehandelde patienten en na falen van o.a. brentuximab plus vedotin
- Nivolumab - Opdivo geeft extreem goede resultaten - 87 procent respons - bij zwaar voorbehandelde patienten met lymfklierkanker
- Genentest met 7 nieuwe genmutaties voorspelt of immuuntherapie met Rituximab aanvullend op CHOP kuren zal slagen of falen bij non-Hodgkin - folluculaire lymfoma copy 1
- Brentuximab Vedotin (SGN-35) blijkt succesvolle aanpak voor gevorderde lymfklierkanker, non-hodgkin lymfomen met CD30 positieve expressie.
- BiovaxID, een vaccin, geeft significant langere ziektevrije tijd bij lymfklierkanker (non-Hodgkin) blijkt uit fase III studie.
- Immuuntherapie bij lymfklierkanker: BiovaxID(TM), een Vaccinatie - immuuntherapie bij non-Hodgkin geeft goede resultaten uit fase I en II en fase III trials.
- Immuuntherapie bij lymfklierkanker: Non-Hodgkin en vaccinatie met BiovaxID is succesvolle en veelbelovende aanpak.
- Pentostatin - Nipent lijkt effectief middel om afstoting tegen te gaan bij immuuntherapie en stamceltransplanties bij verschillende vormen van kanker waaronder lymfklierkanker en leukemie
- Immuuntherapie bij lymfklierkanker: een overzicht van recente ontwikkelingen





Plaats een reactie ...
Reageer op "Immuuntherapie met extra gemoduleerde T-car cells geeft bij zwaar voorbehandelde lymfklierkanker non-Hodgkin alsnog uitstekende resultaten met 33 procent complete remissies"