Raadpleeg ook onze lijst van niet-toxische ondersteuning bij prostaatkanker. :
Provenge is een immuuntherapeutisch middel tegen prostaatkanker dat al 15 jaar en langer is goedgekeurd door FDA en EMA.Alle verdere inlichtingen kunt u vinden op de website van Dendreon, de producent van Provenge - Sipuleucel-T plus de studies en goedkeuring van de EMA. Klik hier voor de goedkeuring van de EMA en gedetailleerde beschrijving wat Provenge - Sipuleucel-T precies voor behandeling is, voor wie is het is bedoeld en in welke doseringen het moet worden gegeven.
Zie verder het artikel hieronder en in gerelateerde artikelen
18 september 2017: ESMO 2017
Aanvullend op onderstaande informatie van oktober 2012 lees dit review studierapport uit 2015 over drie gerandomiseerde studies bij prostaatkankerpatiënten en waarvan de resultaten werden bevestigd als correct op ESMO 2017: Survival Outcomes of Sipuleucel-T Phase III Studies: Impact of Control-Arm Cross-Over to Salvage Immunotherapy waaruit blijkt dat immuuntherapie met Provenge - Sipuleucel-T gevolgd door dendritische celtherapie (APC8015F = een autologe cellulaire immunotherapie) een optie kan zijn voor patiënten met uitgezaaide prostaatkanker.
De overall overleving na de start van de immuuntherapie was echt beduidend langer, 20,7 maanden versus 9,8 maanden, en geeft volgens de onderzoekers een 47% vermindering in kans op overlijden aan prostaatkanker met een APC8015F behandeling (P < 0.001;) , dus wanneer een behandeling met Provenge werd gevolgd door dendritische celtherapie met autologe cellen.
Echter er is geen vergelijking gemaakt met abiraterone en enzalutamine dus of deze resultaten ook echt waardevol zijn en een verandering van behandelingsprotocol kunnen betekenen is niet bewezen. Wel lijkt het interessant om deze aanpak uit te voeren in een eerder stadium van prostaatkanker.
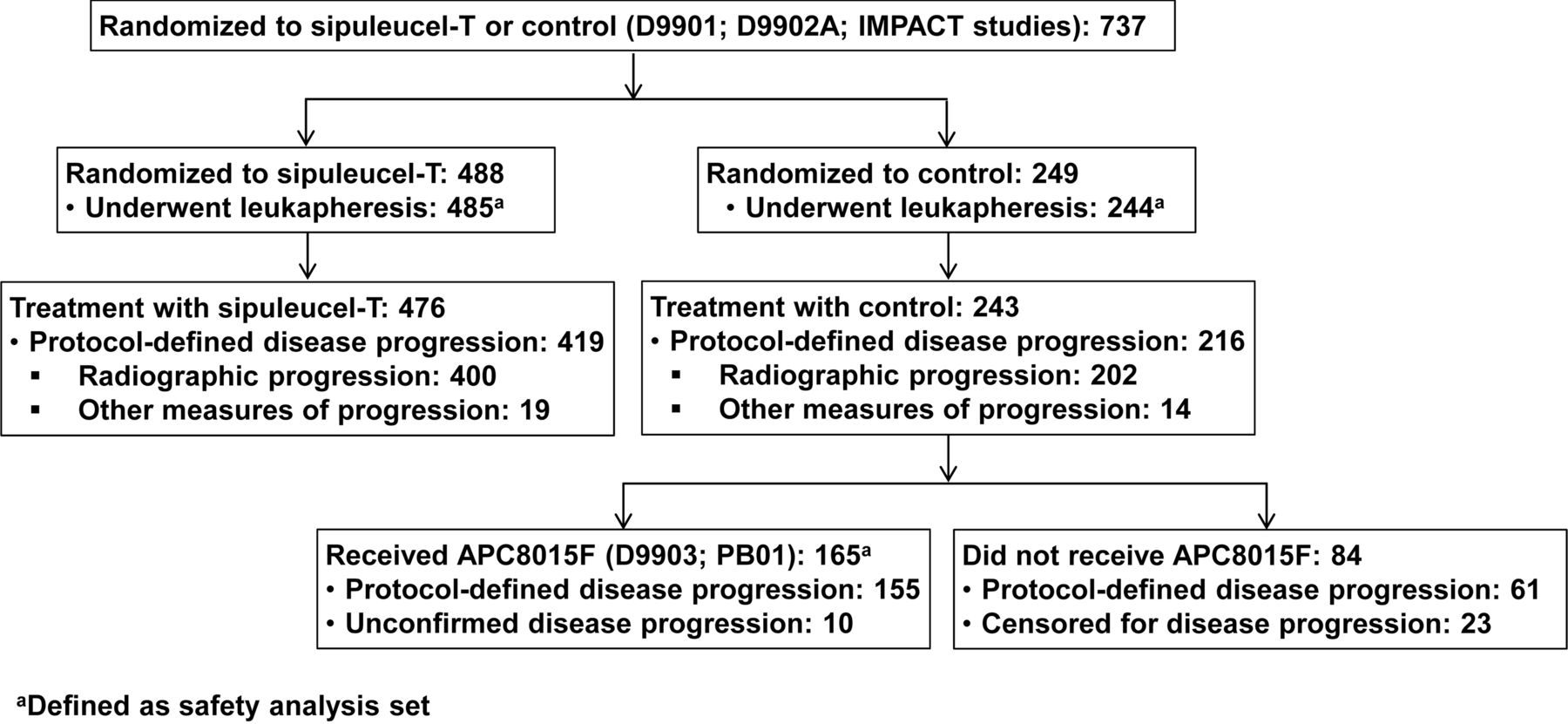
De reviewstudie gaat over deze drie studies, klik op studienummer om te zien welke patienten daarvoor in aanmerking kweamen en welke behandelingen ze hebben gehad. :
D9901 (January 2000–September 2004; clinicaltrials.gov NCT00005947),
D9902A (May 2000–May 2005; NCT01133704),
IMPACT (August 2003–April 2009; primary analysis data cutoff: January 2009; NCT00065442;
Deze onderstaande resultaten zijn nog eens een keer bevestigd:
Onderstaand de grafiek van overall overleving, maar neem daarbij in aanmrkring dat deelnmende patienten veel andere behandelingen hebben gehad en allemaal uitgezaaide hormoonresistente prostaatkanker hadden.
Geschatte overlevingswinst voor sipuleucel-T, na correctie voor een APC8015F behandeling
Uit de gegevens van de drie fase III-studies, werd mediaan een verschil gevonden van 3,9 maanden overall overleving tussen sipuleucel-T en controlegroepen in het voordeel van Provenge - sipuleucel-T. 66,3% van de patiënten uit de controlegroep (n = 165/249) kregen echter ook alsnog APC8015F. Met behulp van IPE-modellering werd de OS-curve van de groep herberekend alsof een APC8015F-behandeling niet had plaatsgevonden; Het verwachte sipuleucel-T behandelingseffect op het mediaan OS was tussen 3,9 maanden (als APC8015F geen effect had) en 8,1 maanden als APC8015F en sipuleucel-T even effectief waren, Figuur 3). Alleen voor de IMPACT-studie, kreeg 63,7% van de patiënten uit de controlegroep APC8015F, en het geschatte sipuleucel-T behandelingseffect op media-OS was tussen 4,1 en 7,8 maanden.
Zie onderstaande grafiek
Figure 3.
Estimates of OS for all patients on the sipuleucel-T phase III trials (N = 737), with adjustment for APC8015F treatment (IPE model). Dotted red line assumes 100% effectiveness of APC8015F, compared with sipuleucel-T, and solid red line assumes 0% effectiveness.
Survival estimates
Kaplan–Meier estimates of median OS from randomization were 25.4 months for sipuleucel-T–treated patients (n = 488), 23.6 months for APC8015F-treated control patients (n = 165), and 12.7 months for control patients not receiving APC8015F (n = 84). Patients were not eligible to receive APC8015F before disease progression. To reduce variability associated with time from randomization to disease progression, analyses of survival from protocol-defined disease progression were also performed; median survival estimates were 20.7 months for sipuleucel-T–treated patients (n = 419), 20.0 months for APC8015F-treated control patients (n = 155), and 9.8 months for control patients not receiving APC8015F (n = 61). Comparing control patients who did/did not receive APC8015F, the unadjusted HR for death was 0.53 (95% CI, 0.38–0.74), representing a 47% reduction in risk of death associated with APC8015F treatment (P < 0.001;
1 oktober 2012: Bron Trial register, met dank aan Henk-Jan
Op de ESMO, het congres in Wenen maakte Dendreon de producent van Provenge - Sipuleucel-T bekend dat zij een open label studie opzetten waaraan prostaatkankerpatiënten uit in principe alle landen uit Europa aan deel kunnen nemen.
Als u hier klikt ziet u de voorwaarden waaronder een adres waar u informatie kunt verkrijgen hoe in te schrijven voor deze studie. Echter de plaatsen zijn wel beperkt - 24 voor nederland - en de voorwaarden zijn wel zwaar. Maar wanneer u denkt hiervoor in aanmerking te komen dan kunt u het natuurlijk altijd proberen.
Hier de aankondiging zoals gedaan op de ESMO:
First Patient In Dendreon EU Open-Label Study Begins Sipuleucel-T Infusion Treatment
Sipuleucel-T Data To Be Presented At The ESMO 2012 Congress (European Society for Medical Oncology)
SEATTLE--(BUSINESS WIRE)-- September 27, 2012--Dendreon Corporation (NASDAQ:DNDN) today announced the first patient enrollment and initiation of treatment for the sipuleucel-T European Union (EU) open-label study. The open-label study is being conducted in European men with metastatic castrate-resistant prostate cancer (mCRPC) to describe product release parameters and report on safety in a European population. The study may enroll up to 45 patients in four sites across the EU. Dendreon has submitted a marketing authorization application (MAA) for sipuleucel-T which is currently under review by the European Medicines Agency (EMA). Sipuleucel-T is not approved for use outside the U.S. Sipuleucel-T is approved by the Food and Drug Administration (FDA) in the U.S. for the treatment of asymptomatic or minimally symptomatic metastatic castrate resistant prostate cancer. It is marketed under the name PROVENGE®.
"We are extremely pleased with the progress of this new study and that the first patient has begun his treatment," said Thomas Powles MD, MRCP, Barts Cancer Institute, St. Bartholomew's Hospital, London. "We are also excited about the potential study outcomes and look forward to a successful program with the support of our committed clinical team and dedicated patients."
In addition to the current EU open-label study, the following data presentations are taking place at the ESMO 2012 Congress in Vienna, Austria, 28 September —2 October:
· Saturday, September 29, 13:00-14:00 CEST — Abstract #939P: "Neoadjuvant Sipuleucel-T in Localized Prostate Cancer: Effects on Immune Cells within the Prostate Tumor Microenvironment." Poster presentation.
· Saturday, September 29, 13:00-14:00 CEST — Abstract #940P: "Overall Survival Benefit with Sipuleucel-T by Baseline PSA: An Exploratory Analysis from Three Phase 3 Trials." Poster presentation.
· Saturday, September 29, 13:00-14:00 CEST — Abstract #941P: "Impact of Salvage Therapy with AC8015F on the Overall Survival Benefit Achieved with Sipuleucel-T in Three Phase III Studies of Metastatic Castrate-Resistant Prostate Cancer. Poster presentation.
· Saturday, September 29, 13:00-14:00 CEST — Abstract #943P: "OpenACT: Phase II, Open-Label Study of Sipuleucel-T in Metastatic Castrate-Resistant Prostate Cancer (mCRPC)." Poster presentation.
· Saturday, September 29, 13:00-14:00 CEST — Abstract #942P: "Antigen Presenting Cell (APC) Activation in Sipuleucel-T: Is Activation Increased in Earlier Prostate Cancer Disease States?" Poster presentation.
Indication and Important Safety Information
Approved for use in the U.S. only.
PROVENGE® (sipuleucel-T) is an autologous cellular immunotherapy indicated for the treatment of asymptomatic or minimally symptomatic metastatic castrate resistant (hormone refractory) prostate cancer.
PROVENGE is intended solely for autologous use and is not routinely tested for transmissible infectious diseases.
The safety evaluation of PROVENGE was based on 601 prostate cancer patients in four randomized clinical trials who underwent at least one leukapheresis. The most common adverse events (incidence greater-than or equal to 15%) are chills, fatigue, fever, back pain, nausea, joint ache, and headache. Serious adverse events reported in the PROVENGE group include acute infusion reactions (occurring within 1 day of infusion) and cerebrovascular events. In controlled clinical trials, severe (Grade 3) acute infusion reactions were reported in 3.5% of patients in the PROVENGE group. Reactions included chills, fever, fatigue, asthenia, dyspnea, hypoxia, bronchospasm, dizziness, headache, hypertension, muscle ache, nausea, and vomiting. No Grade 4 or 5 acute infusion reactions were reported in patients in the PROVENGE group.
To fulfill a post marketing requirement and as a part of the company's ongoing commitment to patients, Dendreon will conduct a registry of approximately 1500 patients to further evaluate a small potential safety signal of cerebrovascular events. In four randomized clinical trials of PROVENGE in prostate cancer patients, cerebrovascular events were observed in 3.5% of patients in the PROVENGE group compared with 2.6% of patients in the control group.
Exploratory analyses indicate that APC8015F treatment may have extended patient survival, suggesting the sipuleucel-T OS advantage in CRPC may be more robust than previously estimated.
Survival Outcomes of Sipuleucel-T Phase III Studies: Impact of Control-Arm Cross-Over to Salvage Immunotherapy
Gerelateerde artikelen
- Afro-Amerikanen met uitgezaaide prostaatkanker doen het beter dan blanke mannen na immuuntherapie met Provenge - sipuleucel-T. Overall overleving was 12 procent beter
- immuuntherapie met Provenge - Spirutacel-T geeft betere resultaten op overall overleving bij gevorderde prostaatkanker als deze gevolgd wordt door dendritische celtherapie
- Provenge, het eerste immuuntherapeutische middel voor prostaatkanker staat ter discussie wegens twijfels over opzet van studies. Ook worden medewerkers van dendreon verdacht van fraude en oplichting
- Provenge - Sipuleucel-T, vaccinatie in combinatie met dendritische cellen bewijst in nieuwe studies te zorgen voor significante levensverlenging bij patienten met hormoonresistente prostaatkanker. Lees hier volledige studierapporten
- Het vaccin Provenge zorgt voor lange uitsteltijd - drie keer zo lang dan zonder Provenge - van PSA stijging na eerste lijnsbehandeling.
- Provenge als immuuntherapie in de vorm van dendritische celtherapie bij hormoonresistente gevorderde prostaatkanker geeft significant meer overlevingen. 3 jaars overleving gaat 38% omhoog. FDA geeft goedkeuring aan Provenge. Zie NEJM studierapport.
- Provenge,- Sipuleucel-T, het immuuntherapeutische middel bij prostaatkanker kost $ 31.000 per injectie. Voor een minimale kuur van 3 injecties is de prijs $ 93.000,--
- Driejaars meting van fase III studie bij prostaatkankerpatiënten en resultaat van fase II studie met gevorderde prostaatkankerpatiënten bewijst opnieuw significant betere resultaten dan placebo van behandeling met Provenge samen met Avastin.
- Dubbelblinde gerandomiseerde fase III studie bewijst uitstekend effect van Provenge. 3,5 keer langere overlevingstijd en minder pijn.
- Provenge een immuuntherapie met dendritische cellen bij prostaatkanker: een aantal artikelen bij elkaar gezet




Plaats een reactie ...
Reageer op "immuuntherapie met Provenge - Spirutacel-T geeft betere resultaten op overall overleving bij gevorderde prostaatkanker als deze gevolgd wordt door dendritische celtherapie"