27 maart 2017: De FDA heeft Avelumab officieel goedgekeurd als medicijn bij zowel patienten die al wel chemo hadden gehad als bij patienten met nieuwe diagnose. Dit laatste is verheugend nieuws want patienten met merkelcelcarcinoom hoeven nu geen chemo te ondergaan voor immuuntherapie kan worden gegeven met avelumab, een anti-PD medicijn.
Hier staat de officiële FDA goedkeuring.
The U.S. Food and Drug Administration today granted accelerated approval to Bavencio (avelumab) for the treatment of adults and pediatric patients 12 years and older with metastatic Merkel cell carcinoma (MCC), including those who have not received prior chemotherapy. This is the first FDA-approved treatment for metastatic MCC, a rare, aggressive form of skin cancer.
“While skin cancer is one of the most common cancers, patients with a rare form called Merkel cell cancer have not had an approved treatment option until now,” said Richard Pazdur, M.D., acting director of the Office of Hematology and Oncology Products in the FDA’s Center for Drug Evaluation and Research and director of the FDA’s Oncology Center of Excellence. “The scientific community continues to make advances targeting the body’s immune system mechanisms for the treatment of various types of cancer. These advancements are leading to new therapies—even in rare forms of cancer where treatment options are limited or non-existent.” Lees verder
17 september 2016: Bron: The Lancet
Avelumab, een anti-PD medicijn geeft bij patiënten met stadium IV merkelcelcarcinoom, een agressieve vorm van huidkanker met veelal een slechte prognose alsnog bijzonder goede resultaten.
28 van de 88 patiënten (31.8%) reageerden goed op de avelumab waarvan 8 patiënten (9%) een CR = complete remissie bewerkstelligden en nog eens 20 patiënten (23%) een PR = gedeeltelijke remissie (PR = 50% of meer vermindering in aantal en omvang van tumoren) Stabiele ziekte werd gezien bij nog eens 9 patiënten (10%). En bij 92% van de patienten die goed reageerden bleek die reactie ook duurzaam. Bij 23 of 28 patiënten (82%) die goed reageeerden met een CR of PR duurt de remissie nog steeds voort. Alle patiënten hadden minimaal maar vaak al meerdere chemokuren achter de rug. En elke patiënt had uitzaaiingen en had stadium 4. Dat maakt het natuurlijk wel bijzonder want in feite waren alle patiënten niet meer te genezen en werden als palliatief beschouwd.
De resultaten van deze fase II studie werd gepubliceerd in de Lancet.
Merkelcelcarcinomen komen vaak voor in en rond het halsgebied, zoals ook bv. kunnen in oren en ogen merkelceltumoren ontstaan. Maar soms ook wel op benen of elders op het lichaam. Zie ook www.merkelcell.org
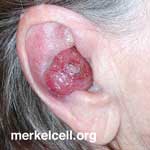 Foto: Merkelceltumor in het oor
Foto: Merkelceltumor in het oor
Studieresultaten:
In de studie, kregen 88 patiënten uit 35 locaties in Noord-Amerika, Europa, Australië en Azië avelumab intraveneus 10 mg / kg elke 2 weken. Het primaire eindpunt was objectieve respons op RECIST (Response Beoordelingscriteria in solide tumoren). Alle patiënten hadden ten minste een behandeling van 1 systemische therapie gehad, en 41% had ten minste twee eerdere systemsiche chemo gehad. De primaire plaats van de kanker was de huid bij 76% van de patiënten. 66% van de tumoren waren positief voor PD-L1-expressie en 55% voor het merkelcelpolyomavirus.
Mediane follow-up was 10,4 maanden. De mediane duur van de behandeling was 17 weken. Objectieve respons werd waargenomen bij 28 patiënten (31,8%, 95,9% betrouwbaarheidsinterval = 21,9% -43,1%), waaronder complete respons bij 8 patiënten (9%) en partiële respons bij 20 patiënten (23%); stabiele ziekte werd waargenomen bij 9 patiënten (10%). Respons werd bereikt bij 34,5% van patiëntne met positieve PD-1 expressie (PD-1) en bij 18,8% met PD-1-negatieve patiënten en bij 26,1% met een polyomavirus positieve- en 35,5% bij polyomavirus-negatieve patiënten.
De remissies zijn bij 23 van de 28 patiënten (82%) nog gaande op het moment van de analyse. Het percentage van de remissies met een duur ≥ 6 maanden was 92%, met een duur variërend van 2.8+ tot 17.5+ maanden en mediane duur is nog niet bereikt. Responsen werden waargenomen bij de eerste tumorbeoordeling in week 7 bij 22 responders (79%).
Bijwerkingen
Grade 3 behandeling gerelateerde bijwerkingen werden waargenomen bij vier patiënten (5%), bestaande uit lymfopenie bij twee patiënten, verhoogde creatinefosfokinase bij een patiënt, verhoogde aminotransferase bij een patiënt, en bij een patiënt een verhoogde cholesterol. Ernstige gerelateerde bijwerkingen die een extgra behjandleing nodig hadden traden op bij vijf patiënten (6%), bestaande uit enterocolitis, infusiegerelateerde reactie, verhoogde aminotransferasen, chondrocalcinosis, synovitis, en interstitiële nefritis. Stopzetting van de behandeling wegens bijwerkingen was nodig bij twee patiënten (2%). Er waren geen behandeling gerelateerde sterfgevallen.
Conclusie:
De onderzoekers concluderen: "Avelumab werd geassocieerd met duurzame reacties, waarvan de meeste nog voortduren en werd goed verdragen; vandaar, avelumab vertegenwoordigt een nieuwe therapeutische optie voor geavanceerde merkelcelcarcinoom."
Het volledige studierapport: Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial is tegen betaling in te zien.
Hier het abstract van de studie:
Avelumab was associated with durable responses, most of which are still ongoing, and was well tolerated; hence, avelumab represents a new therapeutic option for advanced Merkel cell carcinoma.
Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial
DOI: http://dx.doi.org/10.1016/S1470-2045(16)30364-3
Summary
Background
Merkel cell carcinoma is a rare, aggressive skin cancer with poor prognosis in patients with advanced disease. Current standard care uses various cytotoxic chemotherapy regimens, but responses are seldom durable. Tumour oncogenesis is linked to Merkel cell polyomavirus integration and ultraviolet-radiation-induced mutations, providing rationale for treatment with immunotherapy antibodies that target the PD-L1/PD-1 pathway. We assessed treatment with avelumab, an anti-PD-L1 monoclonal antibody, in patients with stage IV Merkel cell carcinoma that had progressed after cytotoxic chemotherapy.
Methods
In this multicentre, international, prospective, single-group, open-label, phase 2 trial, patients with stage IV chemotherapy-refractory, histologically confirmed Merkel cell carcinoma (aged ≥18 years) were enrolled from 35 cancer treatment centres and academic hospitals in North America, Europe, Australia, and Asia. Key eligibility criteria were an ECOG performance status of 0 or 1, measurable disease by Response Evaluation Criteria in Solid Tumors (RECIST) version 1.1, adequate haematological, hepatic, and renal function, and immune-competent status (patients with HIV, immunosuppression, haematological malignancies, and previous organ transplantation were excluded). Patient selection was not based on PD-L1 expression or Merkel cell polyomavirus status. Collection of biopsy material or use of archival tissue for these assessments was mandatory. Avelumab was given intravenously at a dose of 10 mg/kg every 2 weeks. The primary endpoint was confirmed objective response (complete response or partial response) assessed according to RECIST version 1.1 by an independent review committee. Safety and clinical activity were assessed in all patients who received at least one dose of study drug (the modified intention-to-treat population). This trial is registered with ClinicalTrials.gov as NCT02155647.
Findings
Between July 25, 2014, and Sept 3, 2015, 88 patients were enrolled and received at least one dose of avelumab. Patients were followed up for a median of 10·4 months (IQR 8·6–13·1). The proportion of patients who achieved an objective response was 28 (31·8% [95·9% CI 21·9–43·1]) of 88 patients, including eight complete responses and 20 partial responses. Responses were ongoing in 23 (82%) of 28 patients at the time of analysis. Five grade 3 treatment-related adverse events occurred in four (5%) patients: lymphopenia in two patients, blood creatine phosphokinase increase in one patient, aminotransferase increase in one patient, and blood cholesterol increase in one patient; there were no treatment-related grade 4 adverse events or treatment-related deaths. Serious treatment-related adverse events were reported in five patients (6%): enterocolitis, infusion-related reaction, aminotransferases increased, chondrocalcinosis, synovitis, and interstitial nephritis (n=1 each).
Interpretation
Avelumab was associated with durable responses, most of which are still ongoing, and was well tolerated; hence, avelumab represents a new therapeutic option for advanced Merkel cell carcinoma.
Funding
Merck KGaA, Darmstadt, Germany.
Gerelateerde artikelen
- Avelumab een anti-PD medicijn geeft uitstekende resultaten met alsnog complete en gedeeltelijke remissies bij patienten met recidief na chemotherapie van uitgezaaide merkelcelkanker - merkelcelcarcinomen.
- Aldarazalf - Imiquimod krijgt van FDA toestemming om als medicijn tegen niet-melanome huidkankers - basecellcancers - te worden gebruikt na significant positieve resultaten uit twee gerandomiseerde dubbelblinde trials.
- Azurin, een eiwit gehaald uit bacterien zorgt voor opmerkelijk positief effect indien als vaccin toegediend bij melanomen.
- Calcipotriol met 5-fluorouracil (5-FU) gecombineerd in een zalf is een bijzonder effectieve vorm van immuuntherapie tegen actinische keratose (AK), een voorstadium van huidkanker van het type plaveiselcelcarcinoom (SCC)
- Chirurgie + PDT - Foto Dynamische Therapie met bremachlorin geeft veel betere overall overleving op 5 jaar dan alleen chirurgie van melanomen vanuit moedervlekken ontstaan. copy 1
- HPV virus besmetting wordt geassocieerd met bepaalde vormen van huidkanker met het plaveisel carcinoom type. Blijkt uit een retropostpectief onderzoek bij ca. 4000 mensen. met huidkanker. Artikel geplaatst 10 juli 2010
- Immuuntherapie met cemiplimab vooraf aan operatie bij patiënten met operabele huidkanker type cutaan plaveiselcelcarcinoom geeft meer complete remissies dan historische data
- Ingenol mebutate zalf - gel blijkt een snelle en effectieve behandeling voor actinische keratose, vaak een voorstadium van vormen van huidkanker
- Itraconazol, blijkt als hedgehog remmer - anti-PD medicijn - een uitstekend medicijn tegen basaal carcinoom .
- Melanoom: Alle actuele informatie over ontwikkelingen en ook standaard behandelingen bij het behandelen van melanomen op kanker-actueel
- Mohs operatietechniek zorgt voor beste resultaten bij het behandelen van huidkanker, maar wordt slechts mondjesmaat toegepast omdat deze operatietechniek meer tijd kost en duurder is dan andere operatietechnieken of PDT
- PDT - Photo Dynamische Therapy als toepassing bij huidkanker
- Selenium kan basaalcelcarcinoom (BCC) en plaveiselcelcarcinoom (SCC) voorkomen. Studie wijst 60 procent verschil in optreden van huidkanker - BCC en SCC tussen hoogste en laagste concentraties selenium.
- Stichting melanoom, patiëntenorganisatie.





Plaats een reactie ...
Reageer op "Avelumab een anti-PD medicijn geeft uitstekende resultaten met alsnog complete en gedeeltelijke remissies bij patienten met recidief na chemotherapie van uitgezaaide merkelcelkanker - merkelcelcarcinomen."