Helpt u ons om meer van deze artikelen te plaatsen?
3 november 2017: Bron: Cancer Manag Res. 2017; 9: 259–266. Published online 2017 Jun 30.
Wanneer darmkankerpatiënten uitzaaiingen in het buikvlies krijgen (peritoneal metastases (PM)) dan is een operatie plus een hypec (hyperthermic intraperitoneal chemotherapy) nog soms een optie. Maar niet vaak worden patiënten daarvoor aangenomen, zeker niet als er ook nog bv. levertumoren zijn.
Toch blijkt nu uit een grote review studie dat het combineren van een operatie met hypec met ook een verwijdering van levertumoren voor levensverlenging kan zorgen bij darmkankerpatiënten. Aan de hand van de zogeheten Peritoneal Surface Disease Severity Score (PSDSS) worden meestal de patiënten geselecteerd. Echter deze PSDSS heeft tot nu toe niet echt bewezen een betrouwbare prognose te kunnen geven. Wat dat betreft scoort de peritoneal cancer index (PCI) score (hoeveel en hoe groot zijn de uitzaaiingen in de buikholte en buikvlies) beter op de prognose.39
In deze reviewstudie: Patient selection for cytoreductive surgery and HIPEC for the treatment of peritoneal metastases from colorectal cancer wordt een uitstekende analyse gemaakt aan de hand van de literatuur wanneer de beste resultaten kunnen worden verwacht van een operatie plus Hypec. Met of zonder leveruitzaaiingen vanuit darmkanker.
Tekst gaat verder onder het plaatje van een HYPEC:
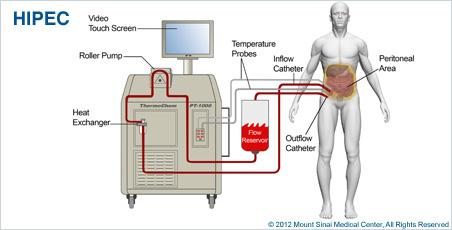 Foto: Een Hipec behandeling
Foto: Een Hipec behandeling
Ik heb de belangrijkste conclusies uit een lang studierapport in het Nederlands vertaald in soort van samenvatting. Maar het volledige studierapport vermeld nog veel en veel meer, maar is zo lang dat ik me kan voorstellen dat u voldoende hebt aan de samenvatting. Het abstract staat onderaan dit artikel met referentieliijst. De nummers in mijn samenvatting verwijzen naar de studies in de referentielijst.
Hoe vaak komen buikvliestumoren (peritoneal metastases (PM)) bij darmkanker voor?
De incidentie van gelijktijdige buikvliestumoren (PM) bij patiënten met darmkanker is ~ 5%, bestaande uit 25% van alle patiënten met geljktijdig een stadium IV-ziekte..13,14
Gezien de PM-cijfers van 40% in de autoptie studies, worden de eerder genoemde percentages beschouwd als een onderschatting van de realiteit.17
Dit kan worden veroorzaakt door een grote groep patiënten zonder specifieke symptomen in welke PM niet tijdens het leven werd ontdekt, waarschijnlijk door de lage nauwkeurigheid van conventionele beeldvorming.18
.jpg) De darmen
De darmen
Risicofactoren voor buikvliestumoren (PM) vanuit darmkanker:
Lemmens et al hebben een gevorderd T-stadium, lymfeklier uitzaaiingen en een slecht differentiatiecijfer geïdentificeerd als onafhankelijke risicofactoren voor synchrone PM.1314–16,19
Naast deze factoren, hebben mucineuze adenocarcinomen en signaalkringcarcinomen de neiging om vaker in het buikvlies uit te zaaien dan andere histologische subtypes.7
Systemische aanpak van buikvliestumoren (PM) vanuit darmkanker:
De hoogste momenteel haalbare mediane overleving bij geselecteerde patiënten behandeld met systemische chemotherapie is 24 maanden.24 Andere studies tonen aan dat de toevoeging van gerichte middelen aan systemische chemotherapie de overall overleving verder kan verbeteren.25,26 Aangezien het buikvlies en buikholte een verminderde bloedtoevoer hebben, blijft de werkzaamheid van de systemische therapie beperkt.
Omvang van buikvliestumoren (PM) als prognosefactor (PCI-score):
Talrijke grote cohortstudies hebben de PCI-score geïdentificeerd als een belangrijke prognostische factor. Goéré et al hebben geconstateerd dat cytoredutie (CRS) en HIPEC geen overlevingsvoordeel lijken te bieden bij patiënten met een PCI score van ≥17.43
Op basis van de resultaten van eerder genoemde studies, zouden chirurgen het uitvoeren van CRS en HIPEC niet moeten uitvoeren bij patiënten met een PCI score van > 20. Bovendien is een gerelateerde factor om geen CRS plus Hypewc te doen de mate van uitzaaiingen in de dunne darm. 44
CRS en HIPEC zuden niet mogen worden uitgevoerd als een dergelijk groot deel van de darm door kanker is aangetast omdat een operatie een dunne darmsyndroom zou veroorzaken.
Tot nu toe blijft diagnostische laparoscopie (kijkoperatie) met histologische bevestiging de gouden standaard voor het diagnosticeren en kwantificeren van buikvliestumoren vanuit darmkanker (PM), ondanks het invasieve karakter daarvan.47
Volledigheid van operatieve verwijdering (cytoreductie (CRS)) lijkt cruciaal voor kansen op overall overleving:
Volledigheid van cytoreductie is zo essentieel dat deskundigen het erover eens zijn dat CRS en HIPEC alleen mogen worden uitgevoerd als complete of bijna volledige macroscopische cytoreductie mogelijk is. 36
In een studie van Verwaal et al hadden patiënten met een rest ziekte van tumoren > 2,5 cm (R2b) een mediane overleving van slechts 5 maanden, vergeleken met 17 maanden bij patiënten met een rest ziekte van tumoren tussen 2,5 en 2,5 cm (R2a) en 39 maanden bij patiënten met macroscopische complete cytoreductie (R1).48 Ook andere studies laten vergelijkbare resultaten zien.31,33,42,49,50
Leveruitzaaiingen: (tekst gaat verder onder scanbeeld van levertumoren vanuit darmkanker)
.jpg)
Darmkankerpatiënten met zowel uitzaaiingen in buikvlies als in de lever zijn in het verleden niet behandeld met curatieve intenties, omdat uit studies is gebleken dat de mediane overall overleving beperkt bleef tot 5 maanden.54 Een curatieve aanpak kan echter overwogen worden bij streng geselecteerde patiënten met beperkte en operabele levertumoren.55,56
Bijgevolg hebben in het afgelopen decennium een aanzienlijk aantal studies gerapporteerd over patiënten die werden behandeld met CRS en HIPEC in combinatie met lokale behandeling van levermetastasen.
Bij deze patiënten bleek een mediane algehele overleving die varieerde van 6 tot 49 maanden, wat lager was dan bij patiënten met alleen buikvliestumoren (PM). .56
Concluderend kan een patiënt met een aangepaste aanpak van darmkankerpatiënten met zowel tumoren in lever als in het buikvlies resulteren in langdurige overleving met aanvaardbare morbiditeit. Desalniettemin lijkt de overleving wel minder ten opzichte van patiënten met alleen buikvliestumoren.60
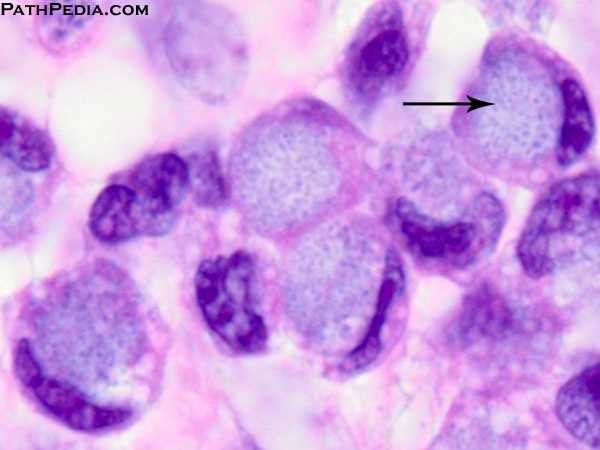 Foto: signetringcelcarcinomen
Foto: signetringcelcarcinomen
In het algemeen wordt darmkanker verdeeld in drie verschillende histologische subtypen; adenocarcinomen (85% -90%), slijmvlies adenocarcinomen (10% -15%) en signetringcelcarcinomen (1%).7
Ongeacht de behandeling wordt de prognose van darmkankerpatiënten met buikvliestumoren (PM) sterk beïnvloed door deze histologische typen.26 Signet ringcel histologie is in het bijzonder geassocieerd met een slechte prognose, met een mediane overleving van <3 maanden bij behandeling met palliatieve zorg.61
Verschillende studies tonen aan dat een ringcel histologie als een belangrijke negatieve factor wordt gezien in relatie tot de mediane overall overleving, variërend van 2,0 tot 3,7 maanden. 41,48,56,66
Niettemin, met betrekking tot palliatieve zorg, kan een vergelijkbare relatieve overlevingswinst worden bereikt door CRS en HIPEC bij patiënten met een signetringcelhistologie in vergelijking met patiënten met adenocarcinomen en mucineuze adenocarcinomen.61
De auteurs van een bevolkingsgerichte studie concluderen dat patiënten met signetringcelcarcinomen ook kunnen profiteren van CRS en HIPEC. Aangezien patiënten met deze vorm van darmkanker vaak jong zijn, kan een agressieve chirurgische benadering een realistische optie zijn in een streng geselecteerde subgroep.
Endeldarmkanker / rectumdarmkanker met uitzaaiingen in het buikvlies:
Bij darmkankerpatiënten worden dikke darmkanker en endeldarmkanker / rectumkanker beschouwd als twee verschilelnde vormen van kanker met voor elk een andere behandeling en prognose. 67,68
Bij patiënten met uitzaaiingen in het buikvlies (PM) die worden behandeld met CRS en HIPEC, zijn deze verschillen tussen dikke darmkanker en endeldarmkanker minder duidelijk. Zij worden in de praktijk meestal gezien als één ziekte, ongeacht hun dikkedarm of endeldarm oorsprong. Als gevolg hiervan camoufleert de grote groep dikke darmkankerpatiënten vaak de resultaten van een klein deel van de patiënten met endeldarmkanker / rectumkanker.
In grote studies die prognostische factoren onderzochten voor overlevingsdata na een CRS en HIPEC, lijkt een rectale oorsprong geen invloed te hebben op de overleving in vergelijking met een oorsprong vanuit de dikkedarm.33,40,56,73
Zelfs in geselecteerde gevallen van lokaal gevorderde endeldarmkanker / rectumkanker met teegelijkertijd uitzaaiingen in het buikvlies (PM), werd een betere overall overleving en een acceptabele morbiditeit bereikt met een combinatie van CRS en HIPEC en intra-operatieve radiotherapie.74
Daarmee kunnen we concluderen dat CRS en HIPEC een haalbare optie kan zijn bij vooraf geselecteerde patiënten met buikvliestumoren (PM) vanuit endeldarmkanker / rectale kanker, met vergelijkbare uitkomsten als patiënten met buikvliestumoren (PM) bij dikke darmkanker.
Neo-adjvante systemische behandeling vooraf aan CRS en Hypec:
Hypothetisch gezien kan neo-adjuvante systemische therapie de kans vergroten op het bereiken van een volledige cytoreductie (totale operatieve verwijdering) door pre-operatieve verkleining van de tumor. Echter, een gepoolde subgroepanalyse van gerandomiseerde studies in geavanceerde darmkanker onderschrijft het dogma dat dikkedarmkanker met uitzaaiingen in het buikvlies vaak resistent is tegen systemische behandelingen in vergelijking met uitzaaiingen in andere organen en plaatsen..22 Door de Blazer-classificatie te gebruiken, rapporteerden Passot et al. een complete en belangrijke pathologische respons van 10% en 20%, maar deze was lager dan de gerapporteerde pathologische respons van darmkanker met leveruitzaaiingen..79–81 Tot nu toe ziojn er geen bewijzen dat een neo-adjuvante systemsiche behandeling vooraf aan een CRS en Hypec betere reusltaten zal geven.
Drie fase II studies onderzoeken op dit moment (d.d. 2017) de veiligheid en dosering. Neo-adjuvant FOLFOX met bevacizumab (BEV-IP trial, NCT02399410), FOLFOXIRI met bevacizumab (CARCINOSIS trial, NCT02591667), en FOLFOX/FOLFIRI met cetuximab (COMBATAC trial, NCT01540344) vooraf aan CRS en HIPEC voor potentieel operabele darmkanker met buikvliesuitzaaiingen (PM).
Resultaten van deze onderzoeken zullen meer inzicht verschaffen in de gevoeligheid van darmkanker met uitzaaiingen in het buikvlies (PM) voor moderne neo-adjuvante chemotherapie / met gerichte medicijnen (targeted therapy).
Naast preoperatieve tumor verkleining, is een verbeterde selectie van patiënten een andere optie en meer algemeen geaccepteerd om voordeel te halen uit neo-adjuvante systemische therapie. Zie o.a deze studies: 24, 77 En de lopende CAIRO6 trial (NCT02758951)
(Red: denk hierbij met name aan een receptoren en DNA onderzoek vooraf aan de neo-adjuvante behandeling. Zowel voor als na als , indien mogelijk, tijdesn de hypec spoelingen zouden op bepaalde receptorenexpressie en DNA mutaties gebaseeerde behandelingen kunnen worden ingezet).
Samengevat kan neo-adjuvante systemische therapie de overall overleving na CRS en HIPEC verbeteren door de selectie van de patiënt te verbeteren, maar het voordeel op basis van intention-to-treat moet worden bevestigd door de resultaten van lopende en toekomstige onderzoeken. (Tekst gaat verder onder grafiek)
Conclusie:
Cytoreductie (CRS) en hyperthermic intraperitoneal chemotherapy (HIPEC) is een haalbare behandelingsoptie voor geselecteerde darmkankerpatiënten met uitzaaiingen in het buikvlies (peritoneal metastases (PM)), resulterend in een verbeterde overall overleving op lange termijn en zelfs volledige genezing bij sommige patiënten. Een adequate selectie van patiënten voor deze behandeling is momenteel een van de grootste uitdagingen. Deze reviewstudie concentreerde zich op verschillende belangrijke punten in dit complexe samenspel van patiënt-, tumor- en behandelkenmerken.
Volgens de beschikbare literatuur hebben vooral de mate van uitzaaiingen in het buikvlies (PM) , de volledigheid van cytoreductie (volledige verwijderijng van de tumoren) en de celhistologie van de signetringcelcarcinomen grote invloed op de uitkomsten na een CRS en HIPEC. De aanwezigheid van levermetastasen lijkt een negatieve prognostische impact te hebben. Daarentegen lijkt behandeling met neo-adjuvante systemische therapie de overleving na CRS en HIPEC te verlengen. Bovendien moet endeldarmkanker / rectale kanker niet worden beschouwd als een sterk negatieve prognostische factor.
Over het algemeen komen alleen darmkankerpatiënten met een beperkte hoeveelheid van tumoren in het buikvlies (PM), met grote kans op een volledige macroscopische cytoreductie en zonder celhistologie van de signetringcelcarcinomen in aanmerking voor een CRS en Hypec. En zijn zij in staat om een overall overleving op lange termijn na een CRS en HIPEC te bereiken.
Prognostische modellen die de bovengenoemde factoren combineren, zoals het nomogram COMPASS, (External Validation of the Prognostic Nomogram (COMPASS) for Patients with Peritoneal Carcinomatosis of Colorectal Cancer) kunnen klinisch relevante hulpmiddelen bieden voor gebruik in de dagelijkse praktijk.
Het volledige studierapport van deze reviewstudie: Patient selection for cytoreductive surgery and HIPEC for the treatment of peritoneal metastases from colorectal cancer is gratis in te zien.
Hier het abstract met bijbehorende referentielijst:
Prognostic models combining the above-mentioned factors, such as the Colorectal Peritoneal Metastases Prognostic Surgical Score nomogram, may provide clinically relevant tools to use in everyday practice.
Patient selection for cytoreductive surgery and HIPEC for the treatment of peritoneal metastases from colorectal cancer
Abstract
Cytoreductive surgery (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC) is a viable option for selected patients with peritoneal metastases (PM) from colorectal origin, resulting in long-term survival and even cure in some cases. However, adequate patient selection for this treatment is currently one of the major challenges. The aim of this review is to provide a comprehensive overview of clinically relevant factors associated with overall survival. This may help to guide clinicians through the complex interplay of patient, tumor, and treatment characteristics to adequately select patients who benefit the most from this extensive surgical treatment. First, basic principles of colorectal PM and the CRS and HIPEC treatment will be discussed. According to available literature, especially extent of peritoneal disease, completeness of cytoreduction, and signet ring cell histology have great influence on the outcome after CRS and HIPEC. Other factors that seem to have a negative prognostic value are the presence of liver metastases and the absence of treatment with neo-adjuvant systemic therapy. Prognostic models combining the above-mentioned factors, such as the Colorectal Peritoneal Metastases Prognostic Surgical Score nomogram, may provide clinically relevant tools to use in everyday practice.
Conclusion
CRS and HIPEC is a viable option for selected patients with PM from colorectal origin, resulting in long-term survival and even cure in some patients. However, adequate patient selection for this treatment is currently one of the major challenges. This review focused on several important issues in this complex interplay of patient, tumor, and treatment characteristics. According to available literature, especially extent of peritoneal disease, completeness of cytoreduction, and signet ring cell histology have great influence on the outcome after CRS and HIPEC. The presence of liver metastases seems to have a negative prognostic impact. In contrast, treatment with neo-adjuvant systemic therapy seems to prolong survival after CRS and HIPEC. Additionally, rectal cancer should not be regarded as a strong negative prognostic factor. In general, only patients with limited peritoneal disease, eligible for complete macroscopic cytoreduction and without signet ring cell histology, are able to achieve long-term survival after CRS and HIPEC. Prognostic models combining the above-mentioned factors, such as the COMPASS nomogram, may provide clinically relevant tools to use in everyday practice.
References
Gerelateerde artikelen
- Chemotherapie voorafgaand aan een HIPEC behandeling geeft nauwelijks langere overleving in vergelijking met HIPEC behandeling zonder chemo vooraf bij in buikvlies uitgezaaide dikkedarmkanker
- Anita blijft kankervrij na drie Hipec behandelingen in het Catharina ziekenhuis voor haar buikvlieskanker en lijkt genezen
- TCM = traditionele Chinese Medicijnen in combinatie met een Hipec = hyperthermic intraperitoneal chemotherapy heeft gunstig effect op met name vocht in de buik (maligne ascites) copy 1
- Hypec - hyperthermische intraperitoneale chemotherapie met mitomycine C naast operatie voor lokaal gevorderde darmkanker stadium IV verbetert ziektecontrole met 10 procent op 3 jaars meting.
- Hyperthermische intraperitoneale chemotherapie (HIPEC) met oxaliplatin aanvullend op cytoreductieve chirurgie geeft geen extra overall overleving in vergelijking met alleen cytoreductieve chirurgie bij in buikvlies uitgezaaide darmkanker
- Hypec - hyperthermisch intraperitoneale chemotherapie, ingezet om tumorvermindering van kelkcel tumoren (blinde darm) en neuro-endocriene tumoren met uitzaaiingen in het buikvlies geeft veel betere overall overleving (39 vs 12 maanden) dan alleen operatie
- Catharina ziekenhuis Eindhoven doet onderzoek naar pipac - chemospoelingen in de buik voor buikvliestumoren ontstaan vanuit darmkanker om eventueel Hypec mogelijk te maken copy 1
- Hoe kunnen oncologen het beste patienten selecteren voor een operatie van buikvliestumoren samen met een HIPEC voor de behandeling van buikvliestumoren vanuit darmkanker.
- Hypec - hyperthermic intraperitoneal chemotherapy naast debulking operatie geeft verbeterde overall overleving 48 versus 34 maanden en langere ziektevrije tijd bij eierstokkankerpatienten
- Hipec - Hypertherme Intraperitoneale Chemotherapie: 25 procent meer 5-jaars overlevingen bij selecte groep patienten met operabele uitzaaiingen in buikvlies, ontstaan vanuit darmkanker, blinde darmkanker en eierstokkanker
- Een HIPEC - Hyperthermic intraperitoneal chemotherapy - samen met een cytoreductieve operatie geeft betere overleving en kan genezende behandeling zijn bij geselecteerde patienten met tumoren in de buikholte en buikvlies
- Hypec-operatie bij uitgezaaide buikvlieskanker van het adenocarcinoomtype geeft significant langere overlevingsresultaten maar wel ernstige bijwerkingen
- HYPEC IPHC - hyperthermie naast chemo bij uitgezaaide buikvlieskanker (colonrectalcancer) van het adenocarcinoomtype geeft significant langere overlevingsresultaten, aldus studie bij 77 patiënten.
- HYPEC - Hyperthermie in combinatie met chirurgie en chemo geeft ook bij Peritoneal Mesothelioma (PM) - buikvlies mesothelioma goede veelbelovende resultaten.
- HYPEC - Hypertherme Intra Peritoneale Chemotherapie informatie



Plaats een reactie ...
Reageer op "Hoe kunnen oncologen het beste patienten selecteren voor een operatie van buikvliestumoren samen met een HIPEC voor de behandeling van buikvliestumoren vanuit darmkanker."