10 december 2018: lees ook dit artikel:
29 maart 2018: Zie ook dit artikel:
8 juli 2014: Bron: EHA congres 2014
Genezende behandeling zonder chemo voor CLL -Chronische Lymfatische Leukemie komt heel dichtbij, bewijst fase I/II studie met een zogeheten BCL-2 remmer, met codenaam ABT-199/GDC-0199.
Van de 105 deelnemende patiënten bleken er 78 evalueerbaar te zijn. 70 tot 80% van deze 78 patiënten gaf een respons te zien op ABT-199/GDC-0199. Van die 78 patiënten bereikten er maar liefst 23% alsnog een totale remissie die al 24 duurt bij tussentijdse analyse. Dat is mede zo bijzonder omdat alle patiënten minimaal met 4 andere medicijnencocktails, chemokuren, waren behandeld en desondanks een recidief kregen.
BCL-2 remmer - ABT-199/GDC-0199, lijkt nog beter en sneller te werken dan Ibrutinib dat al een spectaculaire verbetering betekent voor patiënten met CLL- Chronische Lymfatische Leukemie. En net als Ibrutinib zijn de bijwerkingen alleszins beheersbaar.
Deze resultaten werden gepresenteerd op 14 juni 2014 op het 19e Congress of the European Hematology Association (EHA) door hoofdonderzoeker John Seymour, MD, associate professor en voorzitter van de Afdeling Hematologie en Medische Oncologie aan het Peter MacCallum Cancer Centre in East Melbourne, Australië.
"We hebben een opmerkelijke werkzaamheid gezien in een patiëntenpopulatie met meerdere recidieven of refractaire ziekte, een hoge totale respons en een indrukwekkende aantal patiënten met een volledige remissie, zelfs in een hoog-risico subgroep van patiënten met CLL," aldus dr. John Seymour.
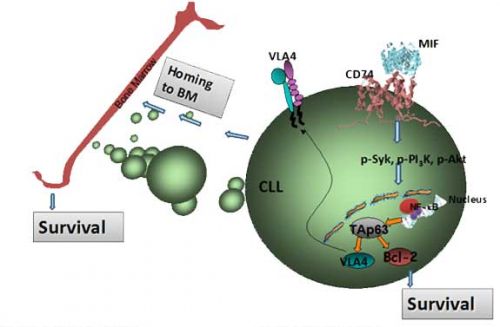
Van CLL cellen is bekend dat het B-cel lymfoom-2 eiwit, dat, samen met andere eiwitten normaal gesproken het apoptoseproces aanstuurt, een overexpressie toont. Dit oraal in te nemen geneesmiddel ABT-199/GDC-0199, (wordt ontwikkeld door AbbVie en Genentech), werd ontworpen om het BH3-bindingselement na te bootsen dat de cellen deelt en daardoor het fysiologische regulerende proces dat gewoonlijk bij de kankercellen apoptose - zefldoding bewerkstelligt, te herstellen. "Het medicijn is een in potentie selectief oraal biologisch beschikbare BCL-2 remmer die de snelle apoptose van CLL-cellen induceert," aldus Dr Seymour. Eerdere analyses van dit medicijn hebben aangetoond dat het een antitumor activiteit bezit en complete remissies kan bewerkstelligen.
.gif)
Studieopzet en resultaten:
Vanaf april werden 105 patiënten geselecteerd, die deelnamen aan de studie. Van de 78 evalueerbare patiënten, bleek de totale respons 77%, met 23% van deze 78 patiënten die een volledige respons lieten zien. Totale repsons betekent totale remissie dus geen aantoonbare kanker op moment van meten. Vergelijkbare werkzaamheid werd gezien in hoog-risico patiënten met de chromosomale afwijking 17p deletie en die met fludarabine-refractaire ziekte - resistent voor fludarabine. En nog belangrijker alle deelnemende patiënten waren eerder behandeld met gemiddeld genomen 4 eerdere behandelingen.
"Deze respons is erg hoog", zegt Stephan Stilgenbauer, MD, associate professor in de Afdeling Hematologie, Oncologie, Reumatologie en Infectieziekten aan de Universiteit van Ulm in Duitsland, die niet betrokken was bij de studie. "Ondanks eerdere zware behandelingen, bleek de respons nog altijd tussen de 70% tot 80% te liggen, en dat is, onafhankelijk van de 17p-status, een bekende chromosoom afwijking die gerelateerd is aan een P53 mutatie. zeer opmerkelijk," aldus dr. Stilgenbauer.
"ABT-199 maakt deel uit van een nieuwe klasse van medicijnen die uiteindelijk chemotherapie als een eerste-lijnsbehandeling kan verdringen", aldus Dr Stilgenbauer in een interview door de EHA.
"Met deze nieuwe medicijnen gericht op de CLL biologische kenmerken en afwijkingen, betreden we een tijdperk waarin chemotherapie als belangrijkste component van een behandeling kan worden vervangen." "Vergeleken met ibrutinib, leidt dit nieuwe medicijn tot een nog snellere celvernietiging." Aldus dr. Stilgenbauer. "Wat namelijk opvalt aan ABT-199 is dat, in vergelijking met ibrutinib, het leidt tot veel snellere cel destructie, zelfs bij CLL-patiënten met een hoog risico".
ABT-199 wordt op dit moment verder onderzocht in fase II en fase III studies bij patiënten met Chronische Lymfatische Leukemie - CLL in combinatie met anti-CD20 monoklonale antilichamen en standaard chemotherapie, aldus de onderzoekers.
Progressievrije overleving blijkt duurzaam:
De onderzoekers vonden in een tussentijdse analyse - april 2014 - minimale ziektekenmerken bij 11 van de 18 patiënten die een volledige remissie hebben bereikt. Zij vonden geen detecteerbare kenmerken van de ziekte bij 6 patiënten en kenmerken van lichte ziekte bij 4 patiënten. Drie patiënten daarvan waren resistent voor fludarabine, 1 had een 17p deletie - afwijking en 1 patiënt was zowel resistent voor fludarabine en had een 17p deletie - afwijking. Een progressie-vrije overleving van 59% werd waargenomen bij patiënten behandeld met ABT-199 met een dosis van 400 mg voor feitelijk 24 maanden.
Eerder onderzoek heeft een verband aangetoond tussen een snelle vernietiging van de tumor met dit medicijn en het risico op het tumorlysissyndroom (TLS). Dr Seymour's team verminderde dit risico door middel van een zorgvuldig gecontroleerd dosis-escalatie regiem, bestaande uit dagelijkse dosis stijging van 20 mg in week 1 (verlaging van de vorige eerste dosis van 50 mg) tot 400 mg in week 5.
Op moment van meting april 2014 waren 37 patiënten (van de 105 totaal) in de studie met het medicijn gestopt - 22 hadden progressieve ziekte, 12 ervaarden te ernstige bijwerkingen, 2 kregen een allogene hematopoietische stamceltransplantatie, en 1 patiënt had warfarine nodig.
De meest voorkomende bijwerkingen waren misselijkheid, diarree, vermoeidheid en bloedarmoede. In termen van graad 3/4 bijwerkingen: 35 (33%) van de patiënten ontwikkelde neutropenie dat gemiddeld 7 dagen duurde, maar verbeterde snel bij ongeveer tweederde van de patiënten die daarvoor een groeifactor ontvingen.
Febriele neutropenie ontwikkelde zich bij 7 (7%) patiënten en TLS ontwikkelde zich bij 7 (7%) patiënten voordat het dosis verhogende opbouwende regiem werd ingesteld. Er zijn geen gevallen van TLS - tumorlysissyndroom meer gezien vanaf het moment dat de systematische dosis opbouw werd ingevoerd.
"Het medicijn geeft een uitstekend veiligheidsprofiel op een lange termijn profiel, met weinig patiënten die stoppen met het geneesmiddel als gevolg van toxiciteit na de eerste weken van de dosering," aldus Dr Seymour.
"Dit zijn inderdaad unieke, hoopgevende gegevens, bereikt met een enkele, relatief niet-toxisch medicijn in een grote groep van CLL-patiënten met een hoog risico," zegt Anton Hagenbeek, MD, van de afdeling Hematologie van het Academisch Medisch Centrum, Universiteit van Amsterdam, die niet betrokken was bij dit onderzoek.
"De studie ziet er erg eenvoudig uit en ik zie op dit moment niet zo snel waar ik kritische kanttekeningen zou kunnen maken," aldus Dr Hagenbeek. "De toekomst ligt in het combineren van deze medicijnen met
andere slimme moleculen of antilichamen om de resultaten nog verder te verbeteren."
Dr Seymour is een consultant voor en heeft de financiering voor het onderzoek ontvangen van AbbVie en Roche / Genentech. Dr Stilgenbauer is een consultant voor Roche. Dr Hagenbeek heeft geen relevante financiële belangen bekendgemaakt.
Het volledige studierapport: REDUCTION OF TUMOR LYSIS SYNDROME (TLS) RISK IN CHRONIC LYMPHOCYTIC LEUKEMIA (CLL) PATIENTS TREATED WITH ABT-199 (GDC-0199) is zover ik weet nog niet beschikbaar.
U zou kunnen proberen om via het hoofdkantoor van de EHA in Amsterdam het volledige studierapport op te vragen:
EHA Congress Secretariat: MCI Amsterdam - Jan van Goyenkade 11 - 1075 HP Amsterdam - Netherlands
Phone: +31 20 679 34 11 - Fax: +31 20 673 73 06 - Email: EHAregistration@mci-group.com
Hier achtereenvolgens het persbericht van de EHA waaruit ik bovenstaande artikel heb gecomponeerd en vertaald en het officiele abstract zoals dat op de EHA 2014 werd gepresenteerd.
ABT-199: Novel Bcl-2 specific inhibitor updated results confirm substantial activity and durable responses in high-risk CLL.
Source: EHA congress 2014
Milan, June 13, 2014 – Promising results from phase-I study for CLL patients will be presented by Dr John Seymour.
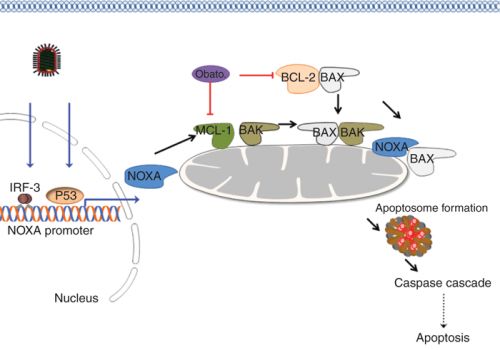
Chronic Lymphocytic Leukaemia (CLL) is the most common leukemia in adults in the Western world and is diagnosed in approximately 5 persons per 100,000 population per year. Whereas many cancers are associated with rapid proliferation of tumor cells, in contrast CLL is largely a disease of gradual “accumulation”, where the leukemic cells have a profoundly prolonged life-span. The mechanism underlying this is an escape from the normal process of physiologic programmed cell death, or apoptosis. The B-cell lymphoma-2 (BCL-2) gene and the derived protein, and related members of the larger family of BCL-2 proteins which share the common “BH3”-binding element in their structure are the regulators of this process of apoptosis and it has long been known that CLL cells overexpress this pro-survival BCL-2 protein.
An oral drug, ABT-199/GDC-0199 was designed to exclusively mimic the binding of this “BH3” structural element exclusively to the BCL-2 protein, hence the drug class designation of “BH3-mimetic”. This action restores the regulatory process that tells cancer cells to self-destruct. The drug is jointly developed by AbbVie and Genentech and is being investigated in a repertoire of studies from phase-I single agent, combination with anti-CD20 monoclonal antibodies and standard chemotherapy, and is in phase-II and –III studies in CLL.
The current presentation updates the results of the CLL arm of the ongoing phase-I single-agent study and establishes;
- The safety of the agent when delivered using a carefully monitored step-wise dose escalation schedule which has largely obviated the earlier risk of rapid tumor destruction with associated chemical imbalances (tumor lysis syndrome; TLS)
- An excellent long-term safety profile with few patients stopping drug due to toxicities beyond the first few weeks of dosing,
- The dose of 400 mg is currently selected for safety expansion, although no formal maximum tolerated dose (MTD) had been defined
- Remarkable efficacy in a patient population with multiply relapsed or refractory disease (overall response rate 77%), with high overall response rates (75 - 79%) and impressive complete remission rates (22 – 29%) and clearance of “minimal residual disease” (MRD) even in the high-risk subsets of patients with the adverse risk del(17p) chromosomal abnormality associated with p53 mutation / dysfunction, an un-mutated immunoglobulin heavy chain gene (IGHV) and those with disease refractory to fludarabine.
- Durable disease control with an actuarial progression free survival of 59% at 24 months for those patients treated at doses of ≥400 mg
Details of these issues are outline in the attached slides summarising the presentation of this data to be presented by Professor John Seymour in the “CLL and related Disorders – Clinical 1” Session 16:15 Sat 14 June in Room Silver (NW Level 2).
Declaration: Prof Seymour has acted as a consultant and member of Advisory Boards to AbbVie, Genentech & Roche.
Presenter: Dr John Seymour
Affiliation: Peter MacCallum Cancer Centre, Australia
Topic: ABT-199: Novel Bcl-2 specific inhibitor updated results confirm substantial activity and durable responses in high-risk CLL.
Abstract S702 will be presented by Dr John Seymour on Saturday, June 14, 2014, 16:15 – 17:30 in Room Silver (NW-Level 2).
REDUCTION OF TUMOR LYSIS SYNDROME (TLS) RISK IN CHRONIC LYMPHOCYTIC LEUKEMIA (CLL) PATIENTS TREATED WITH ABT-199 (GDC-0199): RESULTS OF MODIFICATIONS TO DOSING SCHEDULE AND TLS PROPHYLAXIS
John Seymour* 1, Andrew Roberts2, Stephan Stilgenbauer3, Lori A. Gressick4, Nikita K. Rudersdorf4, Todd Busman4, Wijith Munasinghe4, Shekman Wong4, Monali Desai4, Andrea E. Best4, Elisa Cerri4, Sari H. Enschede4, Rod A. Humerickhouse4
1Peter MacCallum Cancer Centre, 2Royal Melbourne Hospital and Waltern and Eliza Hall Institute of Medical Research, Melbourne, Australia, 3University of Ulm, Ulm, Germany, 4AbbVie, North Chicago, United States
Abstract:
Background: CLL cells have been described as “primed for death” due to over-expression of BCL-2 and abundance of BCL-2:BIM complexes.
ABT-199 is a selective, potent, orally bioavailable small molecule BCL-2 inhibitor being studied as a single agent and in combination in CLL and other B-cell malignancies.
In early clinical studies in patients (pts) with relapsed/refractory CLL, events of TLS were observed, including 2 deaths and one event of acute renal failure, and adjustments to scheduling were required.
Aims: A detailed analysis was performed to identify pre-treatment risk factors for TLS, and to assess the impact of the revised ABT-199 scheduling on TLS incidence.
Methods: Data from 135 CLL pts treated with ABT-199 in 4 studies were analyzed, including all pts treated before the introduction of revised scheduling in April 2013 (n = 77),
and the first 58 pts treated subsequently. Pts with TLS were identified using Cairo-Bishop criteria, and medically adjudicated according to a pre-specified TLS case definition. Predictive modeling and CART analyses, PK, and clinical data were used to categorize risk and to revise dosing regimen and TLS risk mitigation measures.
Results: Among the initial 77 pts, 19 (24.7%) were identified as having had TLS: 3 clinical TLS (2 deaths and 1 acute renal failure), 16 laboratory TLS (LTLS, as designated by investigators or by medical adjudication), 9 with related adverse events and 7 with no intervention and no AE reported. TLS first manifested within 24 hrs of the 1st dose in 14 pts, 4 at 24 – 48 hrs, and 1 TLS related AE reported after a dose increase. Bulky abdominal nodes = 5 cm, ALC = 38k, and CrCl < 80 were identified as individual risk factors for developing LTLS, but a combination of both lymph nodes (LN) = 5 cm and ALC = 38k identified all pts with clinically relevant LTLS. Using LN size and ALC (> 25K to be consistent with historical cut-off) pts were classified into 3 risk groups: low risk - ALC < 25k and all LN < 5 cm; medium risk - ALC = 25k or LN = 5 cm but <10 cm; high risk - ALC = 25k and LN = 5 cm but <10 cm or any pt with LN =10 cm. Of the 19 pts with TLS, 0%, 32%, and 68% (including 3 pts with clinical TLS) were in each respective risk group. In addition, ABT-199 median Cmax and AUC were higher among the subjects experiencing TLS.
These findings led to changes to ongoing protocols. As the TLS risk was largely restricted to the first dose, changes to the dosing regimen included a reduction in the starting dose from 50 to 20 mg. Also, a change from a 3-step to a more gradual, 5-step dose ramp-up (20, 50, 100, 200, final dose) was implemented and the maximum dose was limited to 600 mg. Hospitalization to monitor and collect laboratory data was mandated at the 20 mg and 50 mg doses for all pts and at subsequent dose increases for pts in the high risk group. Detailed guidance on interventions for specific electrolyte changes and a pt management checklist were provided. As of Dec 20, 2013, 58 pts had been treated using the new monitoring and dosing schedule. No events of clinical TLS were reported and 8 pts were identified as meeting Cairo-Bishop criteria for LTLS (13.8%). Three of these pts had AEs reported; all were grade 1 and managed with rapid resolution. In general, lab changes were primarily elevations of phosphate/decreases in calcium, not potassium elevations.
Summary/Conclusion: Changes implemented in the ABT-199 dosing schedule and pt monitoring reduce the risk of clinically relevant TLS. Optimization of monitoring and prophylaxis measures is currently ongoing.
EHA Congress Secretariat: MCI Amsterdam - Jan van Goyenkade 11 - 1075 HP Amsterdam - Netherlands
Phone: +31 20 679 34 11 - Fax: +31 20 673 73 06
Website: http://www.ehaweb.org/congress-and-events/annual-congress/19th-congress/key-info
Gerelateerde artikelen
- Pirtobrutinib, een niet-covalente BTK remmer, blijkt effectief bij zwaar voorbehandelde patiënten met chronische lymfatische leukemie (CLL) of kleincellig lymfatisch lymfoom (SLL) die eerder een covalente BTK remmer hadden gehad
- Reviewstudie beschrijft hoe je het beste patienten met CLL = Chronische Lymfatische Leukemie kunt diagnosteren en welke behandelingen het beste zijn te gebruiken in verschillende stadia van de ziekte.
- Venetoclax plus rituximab geeft ook bij jonge en fitte patiënten met chronische lymfatische leukemie en zelfs bij ongemuteerde IGHV veel complete remissies
- acalabrutinib als monotherapie verbeterde progressievrije overleving aanzienlijk met lager bijwerkingenprofiel dan idelalisib + rituximab of bendamustine + rituximab bij gevorderde CLL - chronische lymfatische leukemie
- Ibrutinib geeft veel betere resultaten op ziekteprogressievrije overleving (87 vs 74 procent) dan bendamustine plus rituximab bij onbehandelde oudere CLL patienten. Rituximab lijkt zinloos naast ibrutinib
- Man - 48 jaar - met al 20 jaar Chronische Lymfatische Leukemie (CLL) weigert chemo en bereikt een langdurige en duurzame remissie na behandeling met Epigallocatechin-3-gallate, een extract van groene thee. copy 1
- BCL-2 remmer - ABT-199/GDC-0199 geeft spectaculaire resultaten bij vergevorderde zwaar voorbehandelde CLL -Chronische Lymfatische Leukemie met alsnog 23 procent totale remissies van minimaal 2 jaar
- Ibrutinib geeft veel betere ziektevrije tijd (plus 45 procent) in vergelijking met rituximab bij recidief van chronische lymfatische leukemie en SLL - lymfklierkanker
- Ibrutinib aanvullend op Bendamustine en Rituximab verbetert progressievrije ziekte en overall overleving met tientallen procenten bij Chronische Lymfatische Leukemia en recidief van lymfklierkanker met kleine tumoren copy 1
- Ibrutinib - Tyrosine kinase (BTK) remmer PCI 32.765 - Ibrutinib zorgt voor langere ziektevrije tijd met veel minder bijwerkingen bij patiënten met CLL - chronische lymfatische leukemie bevestigen nieuwe studies copy 1
- Idelalisib naast rituximab zorgt voor significant langere overleving en progressievrije tijd bij patienten met CLL - chronische lymfatische leukemie waarvoor chemo niet meer mogelijk was
- Groene thee extract zorgt binnen enkele maanden voor significante remissie bij CLL patienten (Chronische Lymfatische Leukemie) . Nieuwe fase II studie bevestigt eerdere goede resultaten. copy 1
- Ofatumumab door FDA goedgekeurd als medicijn voor patienten met CLL - Chronische Lymfatische Leukemie, ongevoelig geworden voor fludarabine en alemtuzumab.
- Combinatiebehandeling van fludarabine en alemtuzumab geeft significant langere ziektevrije tijd en betere overleving voor eerder behandelde CLL patienten
- Rituximab naast Fludarabine en cyclophosphamide geeft significant betere resultaten op ziektevrije tijd en op overleving bij CLL en wordt eerste lijns.
- CLL - Chronische Lymfatische Leukemie: een overzicht



Plaats een reactie ...
Reageer op "BCL-2 remmer - ABT-199/GDC-0199 geeft spectaculaire resultaten bij vergevorderde zwaar voorbehandelde CLL -Chronische Lymfatische Leukemie met alsnog 23 procent totale remissies van minimaal 2 jaar"