29 maart 2018: Zie ook dit artikel:
4 mei 2017:
Lees ook dit artikel
29 juli 2014: onderaan toegevoegd persbericht van FDA voor uitbreiding van Ibrutinib bij CLL - Chronische Lymfatische Leukemie: FDA expands approved use of Imbruvica for chronic lymphocytic leukemia
28 juli 2014:
Lees naast onderstaand artikel over ibrutinib ook het artikel:
en het artikel: Idelalisib naast rituximab zorgt voor uiterst spectaculaire langere overleving en progressievrije tijd bij patiënten met CLL - chronische lymfatische leukemie waarvoor chemo niet meer mogelijk was in verband met verminderde nierfunctie, comorbiditeit en beenmergonderdrukking, veroorzaakt door eerdere behandelingen welke nog extra behandelingsopties bieden aan uitbehandelde CLL patiënten.
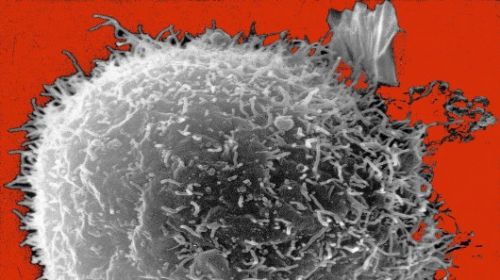
Abnormal lymphocyte being attacked by macrophages (upper right), which lead to enhanced growth and progression of many cancers (Photo: National Cancer Institute)
28 juli 2014:
Twee nieuwe medicijnen, Ibrutinib en Idelalisib voor de behandeling van o.a. chronische lymfatische leukemia (CLL) zullen ook snel in Europa beschikbaar zijn zo meldt de EMA
Ibrutinib (Imbruvica, Janssen) en idelalisib (Zydelig, Gilead) zijn beiden aanbevolen voor officiële toestemming door het European Medicines Agency's (EMA) Committee for Medicinal Products for Human Use (CHMP) op hun vergadering van afgelopen week.
Zie ook hieronder de informatie over Ibrutinib. Hier het persbericht van de FDA die de toediening van Ibrutinib heeft utigebreid. Eerst moest iemand twee chemokuren hebben gevolgd voordat Ibrutinib mocht worden gegeven, nu nog maar 1. FDA expands approved use of Imbruvica for chronic lymphocytic leukemia
Het belangrijkste is dat het chromosoom 17p wordt getest want wie daar een mutatie heeft is ongevoelig voor standaard behandelingen.
18 december 2013:
Op the American Society of Hematology (ASH) heeft dr. Byrd, director of hematology van het Ohio State University Comprehensive Cancer Center in Columbus, betrokken bij de studies naar Ibrutinib bij CLL - chronische lymfatische leukemie bevestigd dat nagenoeg alle (n=31) vooraf nog niet behandelde patiënten (96%) uit een fase II studie die goed reageerden op Ibrutinib nog steeds geen tekenen tonen van ziekteprogressie of een recidief. Slechts 1 patiënt uit die groep van 31 heeft de afgelopen 2 tot 3 jaar een recidief gehad na het eerste jaar. Van de patiënten die al meerdere behandelingen vooraf hebben gehad en met hun ziekte in een gevorderd stadium zaten blijkt 70% van de 131 deelnemende patienten nog steeds geen tekenen van een recidief te hebben en hebben dus een duurzame remissie bereikt. Volgens dr. Byrd is dat veel beter dan normaal wordt verwacht bij deze groep van patiënten. Volgens dr. Byrd krijgt ca. 50% van patiënten alsnog een remissie na een eerste behandeling , ook als zij goed reageren op tot nu toe gebruikte medicijnen en behandelingen. Hij stelt dan ook dat de aanpak van CLL zal veranderen en chemo niet meer de eerste lijns zal worden maar Ibrutinib of vergelijkbare zogeheten tyrosine kinase remmers.
Hier een paar originele citaten van dr. Byrd in een interview met Medcape:
"Patients receiving ibrutinib are doing much better than historically what we're used to seeing with CLL," Dr. John Byrd, a co-leader of the study, said in a telephone interview.
The 148-patient ibrutinib extension study looked at both previously untreated CLL patients and those who had relapsed or stopped responding following prior therapies.
With a median follow-up of more than 27 months of treatment, nearly all of the treatment-naive patients and almost three quarters of the relapsed and refractory patients had no evidence of the disease progressing.
Researchers had not yet been able to determine the median progression-free survival.
Among previously untreated patients, about 96% had not yet experienced disease progression, with just one of 31 patients in that group relapsing so far, researchers said.
Typically you would expect about 50% to see disease progression at two years, Byrd explained.
"You don't even need a statistician to see the difference. The data are better," he said.
Of the 117 previously treated patients in the extension study, 21 had experienced disease progression and 11 had died within 30 days of receiving their last dose of the drug. That left more than 70% whose disease remained in check.
Lees hieronder meer over Ibrutinib:
15 november 2013: De FDA - Federal Drug Administration heeft Ibrutinib - Imbruvica goedgekeurd om te gebruiken als eerste lijns medicijn bij MCL- Mantel Cell Lymfoma, een weinig voorkomende vorm van bloedkanker - leukemie na slechts een fase II studie, maar wel met significant goede resultaten. Zie onderaan abstract van die studie.
Maar positief nieuws dus want weer een vorm van kanker die niet door chemo hoeft te worden behandeld met een veel minder belastende zogeheten tyrosine kinase remmer. Lees hieronder daar meer over waar Ibrutinib - Imbruvica ook voor goede resultaten zorgt bij CLL - Chronische Lymfatische Leukemie. FDA persbericht van officiële goedkeuring staat onderaan artikel.
23 september 2013: Over CLL - chronische lymfatische leukemie is in augustus 2013 ook een studiepublicatie verschenen die alle behandelingen - medicijnen voor CLL op een rijtje heeft gezet en uitlegt wat de voordelen en nadelen van deze medicijnen zijn. Dit volledige studierapport: Novel agents for chronic lymphocytic leukemia is gratis in te zien en geeft een duidelijk beeld van de stand van zaken bij CLL - Chronische lymfatische leukemie.
21 juni 2012: Bron: ASCO 2012 - Cancer Discov. 2012 May;2(5):OF8. Epub 2012 Mar 31.
Ibrutinib - Imbruvica geeft uitstekende resultaten als behandeling van chronische lymfatische leukemie (CLL). Dit blijkt uit de tussen resultaten van een fase II studie en gepresenteerd op ASCO 2012.
Ibrutinib (voorheen bekend onder codenaam PCI-32765) is een medicijn dat oraal kan worden ingenomen en dat een zogeheten tyrosine kinase remmer is. Eerdere eerste resultaten van studies met Ibrutinib werden vorig jaar, zie onderaan dit artikel, al door deskundigen bestempeld als baanbrekend bij de behandeling van CLL - chronische lymfatische leukemie. Nu blijkt uit de tussentijds opgemaakte resultaten uit de follow-up van een fase II studie dat de resultaten alle verwachtingen inlossen.
De progressie vrije overleving bij patiënten met niet eerder behandelde CLL was 96% gemeten op 15 maanden en bij patiënten met een recidief en eerder al behandeld blijkt die progressievrij tijd nog altijd 87,7% te zijn na 18 maanden. Volgens Susan O'Brien, MD, van de Universiteit van het Texas MD Anderson Cancer Center in Houston zou de behandeling met Ibrutinib een eerste lijns behandeling moeten worden omdat juist bij nog niet behandelde patiënten de behandeling bijzonder effectief lijkt te zijn. Vooral de vermindering van de omvang van de lymfklieren gebeurt meestal heel snel na behandeling met Ibrutinib. Binnen twee maaanden verminderde bij de meeste patiënten de lymfklier omvang met 50% of meer. Maar daar staat tegenover dat de lymfocyten in eerste instantie toenemen in het bloed, maar deze nemen af in de loop van de tijd en patiënten zien dan toch een gedeeltelijke of totale remissie ontstaan.
In de PCYC-1102-CA studie waren er 5 behandelgroepen - 3 groepen die ibrutinib 420 mg per dag en 2 groepen die ibrutinib 840 mg per dag kregen. De lage dosis groepen bestonden gemengd uit patiënten met recidiverende / refractaire CLL, niet eerder behandelde patiënten ouder dan 65 jaar, en patiënten met een hoog risico op een recidief. De hoge dosis groepen bestond uit patiënten met recididiverende, refractaire CLL ouder dan 65 jaar, en niet eerder behandelde patiënten ouder dan 65 jaar. De meerderheid van de patiënten in de niet eerder behandelde groepen waren ouder dan 75 jaar. Slechts 6% van de niet eerder behandelde patiënten hadden een afwijking van de 17p13 chromosomale regio, terwijl 36% van de patiënten met recidiverende, refractaire CLL deze afwijking hadden. Bij slechts 1 patiënt in de lage dosis groep ontstond progressie van de ziekte. Vier patiënten in de lage dosis groep en 1 in de hoge dosis stopten met de inname van ibrutinib.
De meest voorkomende bijwerking was diarree, die vanzelf overging. Volgens onderzoeksleidster Susan O'Brien zijn de gebruikte medicijnen niet zogeheten myelosuppressief - zij tasten het beenmerg, de witte bloedlichaampjes, niet aan. Graad 3/4 hematologische toxiciteit met 3 graad 3/4 infecties was minimaal bij deze populatie van 65 plussers. zegt Dr O'Brien.
Ibrutinib in combinatie met andere medicijnen
Jennifer Brown, MD, assistent-professor aan de Harvard Medical School in Cambridge, Massachusetts, presenteerde interim gegevens over ibrutinib in combinatie met bendamustine en rituximab (Rituxan).
Patiënten krijgen ibrutinib 420 mg per dag in cycli van 28 dagen plus bendamustine 70 mg / m² op dag 1 en 2 en rituximab 375 mg / m² in cyclus 1 en 500 mg / m² in cycli 2 tot 6, tot progressie van de ziekte optreed. 23% van de patiënten zijn ouder dan 70 jaar en 40% van deze patiënten hebben 3 voorgaande behandelingen gehad..
Op dit moment is de mediane follow-up 8,1 maanden, met 77% van de patiënten die nog steeds meedoen aan de studie en de medicijnen krijgen toegediend.
Over het algemeen is de respons na een mediane follow-up 93%, met 13% van de patiënten die een volledige remissie hebben bereikt, aldus dr. Brown. Zij voegt eraan toe dat deze resultaten beter zijn in vergelijking met historische gegevens die vorig jaar zijn gepubliceerd (J Clin Oncol 2011;. 29:3559-3566), waarin bendamustine en rituximab een algemeen responspercentage liet zien van 59% bij recidiverende patiënten (met 9% die een complete remissie realiseerden). Er werden geen extra toxische effecten waargenomen als ibrutinib wordt toegevoegd aan bendamustine en rituximab. Op dit moment wordt een fase III studie opgezet.
Als u hier klikt kunt u een artikel lezen uit medscape waaruit ik bovenstaande heb gecomponeerd. Tegen betaling kunt u het volledige studierapport lezen op de website van Cancer Discovery
12 december 2012: Bron: American Society of Hematology (ASH) 53rd Annual Meeting
Een nieuw medicijn, de Bruton's tyrosine kinase (BTK) - remmer PCI 32.765 geeft opmerkelijk veel langere ziektevrije tijd met veel minder bijwerkingen dan bij chemo bij patiënten met een recidief van CLL - chronische lymfatische leukemie. Op het jaarlijkse congres in Amerika over hematology presenteerden onderzoekers een tussen evaluatie van een gerandomiseerde fase II studie die door de collega's als opmerkelijk goed werd ontvangen. PCI-32765 is een oraal in te nemen middel dat een onomkeerbare remmer is van de zogeheten Bruton's tyrosine kinase (BTK).
De studie omvat twee groepen van patiënten met CLL (n = 61): diegenen die niet eerder behandeld waren en in leeftijd 65 jaar of ouder, en patiënten met recidiverende / refractaire ziekte (ziekte komt steeds terug na succesvolle behandelingen) na ten minstens twee eerdere therapieën, inclusief fludarabine. Patiënten kregen elke dag in cycli van 28 dagen oraal PCI-32.765 toegediend tot progressie van de ziekte optrad.
1 groep (n = 27) kregen 420 mg (samengesteld uit patiënten die niet eerder waren behandeld en patiënten met recidiverende / refractaire ziekte), en de andere groep (n = 34) kregen 840 mg per dag (deze groep bestond uit alleen patiënten met recidiverende / refractaire ziekte).
De resultaten die werden gepresenteerd:
De mediane follow-up tijd, dus ziektevrije tijd in dit geval want de behandeling stopte als er sprake was van een recidief, voor de 420-mg groep was 10,2 maanden en 6,5 maanden voor de 840 mg groep. Het gemiddelde van voorafgaande behandelingen voor de 420-mg groep was 3 (range, 2 - 10), en voor de 840 mg groep was dat 5 (totaal bereik, 1 - 12). Daarnaast was bij 72% van de patiënten sprake van een slechte moleculaire functie en daarmee waren deze patiënten zogeheten hoog risico patiënten, wat betekent dat ze een erg grote kans op een recidief hadden.
Bij een mediaan van 10,2 maanden follow-up, had 70% van de patiënten die een lagere dosis van PC-32765 kregen een objectieve respons - de behandeling sloeg aan volgens de gemeten waarden. Dit is een stijging van 48%, die aanvankelijk werd gezien bij 6,2 maanden mediane follow-up.
De objectieve mate van respons was 44% bij 6,5 maanden mediane follow-up voor patiënten die een hogere dosis van het middel hadden gekregen. Daarnaast bleek bij 19% van de patiënten in de lage dosis groep en 35% aan wie de hogere dosering was gegeven een gedeeltelijke respons van de groei van de lymfklieren (> 50% daling van de totale lymfekliergrootte).
De totale respons lijkt onafhankelijk te zijn van de moleculaire risico factoren en 82% van de patiënten (50/61, 420 mg-cohort, 22/27, 840 mg-cohort, 28/34) kon doorgaan met de PCI-32765 behandeling. Tot nu toe hebben slechts 8% (5 / 61) van de patiënten een aantoonbare progressieve ziekte.
Na 6 maanden was de progressie-vrije overleving 92% bij de patiënten die 420 mg PCI-32765 kregen en 90% in de 840 mg groep.
De belangrijkste bijwerking was diarree, die meestal mild was en ging meestal vanzelf weg zonder medicijngebruik.
Slechts bij 2 patiënten werd de behandeling als gevolg van bijwerkingen onderbroken, terwijl 6 patiënten een lagere dosis nodig hadden van de PCI-32765 dosis (420 mg-cohort, 2 / 27; 840-mg cohort, 4 / 34). Graad 1 of 2 diarree, vermoeidheid, misselijkheid en blauwe plekken zijn de meest frequent gerapporteerde bijwerkingen en werden gemeld bij 38% van de patiënten. Ernstige bijwerkingen, graad 3 of meer, die mogelijk werden beschouwd als gerelateerd aan de PCI-32765 deed zich voor bij 21% van de patiënten.
Een onafhankeljk deskundige merkte op: "Wat zo interessant is aan deze resultaten is dat van de behandelde patiënten, ongeveer 70% een hoog risico op een recideif had door moleculaire en cytogenetische kenmerken en dat het gemiddelde aantal van voorafgaande behandelingen lag tussen de 3 en 5, afhankelijk van de lage of hoge dosis groep, Dus de objectieve reacties zijn echt heel opmerkelijk voor deze zwaar voorbehandelde hoog-risico populatie."
Hier een gedeelte uit een groter artikel dat Medscape over deze studie schreef. het gehele artikel kunt u lezen als u hier klikt.
High Progression-Free Survival
PCI-32765 is the first drug developed to target BTK, and the trial included 2 cohorts of patients with CLL (n = 61): those who were previously untreated and were aged 65 years or older, and those with relapsed/refractory disease after at least 2 prior therapies, including fludarabine. Patients were treated with oral PCI-32765 administered daily for 28-day cycles until progression of disease.
One group (n = 27) received 420 mg (previously untreated and relapsed/refractory), and the other group (n = 34) received 840 mg daily (relapsed/refractory). Dr. O'Brien reported only on the patients with relapsed/refractory disease.
The median follow-up time for the 420-mg cohort was 10.2 months; it was 6.5 months for the 840-mg cohort. The median number of prior treatment regimens for the 420-mg cohort was 3 (range, 2 - 10), and for the 840-mg cohort it was 5 (range, 1 - 12). In addition, 72% of patients had at least 1 poor-risk molecular feature: del(17p), 31%; del(11q), 33%; immunoglobulin heavy chain unmutated, 57%.
At a median of 10.2 months of follow-up, 70% of patients who received a lower dose of PC-32765 achieved an objective response. This is an increase from 48%, which was initially reported at 6.2 months median follow-up.
The objective response rate was 44% at 6.5 months median follow-up for patients who received a higher dose of the agent. In addition, 19% of patients in the low-dose group and 35% who received the larger dosing achieved a nodal partial response (>50% reduction in aggregate lymph node size) with residual lymphocytosis.
The authors note that in the majority of patients, there was a transient phase of lymphocytosis, which typically peaked during the first 2 months of therapy and resolved over time. The overall response rate appears to be independent of molecular risk features, and 82% of patients (50/61; 420-mg cohort, 22/27; 840-mg cohort, 28/34) continue to receive PCI-32765. Thus far, only 8% (5/61) of patients have had progressive disease.
At 6 months, progression-free survival is 92% among patients receiving 420 mg PCI-32765, and 90% in the 840-mg cohort.
The U.S. Food and Drug Administration today approved Imbruvica (ibrutinib) to treat patients with mantle cell lymphoma (MCL), a rare and aggressive type of blood cancer
FDA NEWS RELEASE
For Immediate Release: Nov. 13, 2013
Media Inquiries: Stephanie Yao, 301-796-0394, stephanie.yao@fda.hhs.gov
Consumer Inquiries: 888-INFO-FDA
FDA approves Imbruvica for rare blood cancer
Second drug with breakthrough therapy designation to receive FDA approval
The U.S. Food and Drug Administration today approved Imbruvica (ibrutinib) to treat patients with mantle cell lymphoma (MCL), a rare and aggressive type of blood cancer.
MCL is a rare form of non-Hodgkin lymphoma and represents about 6 percent of all non-Hodgkin lymphoma cases in the United States. By the time MCL is diagnosed, it usually has already spread to the lymph nodes, bone marrow and other organs.
Imbruvica is intended for patients with MCL who have received at least one prior therapy. It works by inhibiting the enzyme needed by the cancer to multiply and spread. Imbruvica is the third drug approved to treat MCL. Velcade (2006) and Revlimid (2013) are also approved to treat the disease.
“Imbruvica’s approval demonstrates the FDA’s commitment to making treatments available to patients with rare diseases,” said Richard Pazdur, M.D., director of the Office of Hematology and Oncology Products in the FDA’s Center for Drug Evaluation and Research. “The agency worked cooperatively with the companies to expedite the drug’s development, review and approval, reflecting the promise of the Breakthrough Therapy Designation program.”
Imbruvica is the second drug with breakthrough therapy designation to receive FDA approval. The Food and Drug Administration Safety and Innovation Act, passed in July 2012, gave the FDA the ability to designate a drug a breakthrough therapy at the request of the sponsor if preliminary clinical evidence indicates the drug may offer a substantial improvement over available therapies for patients with serious or life-threatening diseases.
The FDA is approving Imbruvica under the agency's accelerated approval program, which allows the FDA to approve a drug to treat a serious disease based on clinical data showing that the drug has an effect on a surrogate endpoint that is reasonably likely to predict a clinical benefit to patients. This program provides earlier patient access to promising new drugs while the company conducts confirmatory clinical trials. The FDA also granted Imbruvica priority review and orphan-product designation because the drug demonstrated the potential to be a significant improvement in safety or effectiveness in the treatment of a serious condition and is intended to treat a rare disease, respectively.
Imbruvica’s accelerated approval for MCL is based on a study where 111 participants were given Imbruvica daily until their disease progressed or side effects became intolerable. Results showed nearly 66 percent of participants had their cancer shrink or disappear after treatment (overall response rate). An improvement in survival or disease-related symptoms has not been established.
The most common side effects reported in participants receiving Imbruvica are low levels of platelets in the blood (thrombocytopenia), diarrhea, a decrease in infection-fighting white blood cells (neutropenia), anemia, fatigue, musculoskeletal pain, swelling (edema), upper respiratory infection, nausea, bruising, shortness of breath (dyspnea), constipation, rash, abdominal pain, vomiting, and decreased appetite. Other clinically significant side effects include bleeding, infections, kidney problems and the development of other types of cancers.
Imbruvica is co-marketed by Sunnyvale, Calif.-based Pharmacyclics and Raritan, N.J.-based Janssen Biotech, Inc. Velcade (bortezomib) is marketed by Millennium Pharmaceuticals, based in Cambridge, Mass. Revlimid (lenalidomide) is marketed by Summit, N.J.-based Celgene
Ibrutinib shows durable single-agent efficacy in relapsed or refractory mantle-cell lymphoma
Targeting BTK with Ibrutinib in Relapsed or Refractory Mantle-Cell Lymphoma
N Engl J Med 2013; 369:507-516 August 8, 2013 DOI: 10.1056/NEJMoa1306220
Background
Bruton's tyrosine kinase (BTK) is a mediator of the B-cell–receptor signaling pathway implicated in the pathogenesis of B-cell cancers. In a phase 1 study, ibrutinib, a BTK inhibitor, showed antitumor activity in several types of non-Hodgkin's lymphoma, including mantle-cell lymphoma.
Methods
In this phase 2 study, we investigated oral ibrutinib, at a daily dose of 560 mg, in 111 patients with relapsed or refractory mantle-cell lymphoma. Patients were enrolled into two groups: those who had previously received at least 2 cycles of bortezomib therapy and those who had received less than 2 complete cycles of bortezomib or had received no prior bortezomib therapy. The primary end point was the overall response rate. Secondary end points were duration of response, progression-free survival, overall survival, and safety.
Results
The median age was 68 years, and 86% of patients had intermediate-risk or high-risk mantle-cell lymphoma according to clinical prognostic factors. Patients had received a median of three prior therapies. The most common treatment-related adverse events were mild or moderate diarrhea, fatigue, and nausea. Grade 3 or higher hematologic events were infrequent and included neutropenia (in 16% of patients), thrombocytopenia (in 11%), and anemia (in 10%). A response rate of 68% (75 patients) was observed, with a complete response rate of 21% and a partial response rate of 47%; prior treatment with bortezomib had no effect on the response rate. With an estimated median follow-up of 15.3 months, the estimated median response duration was 17.5 months (95% confidence interval , 15.8 to not reached), the estimated median progression-free survival was 13.9 months (95% CI, 7.0 to not reached), and the median overall survival was not reached. The estimated rate of overall survival was 58% at 18 months.
Conclusions
Ibrutinib shows durable single-agent efficacy in relapsed or refractory mantle-cell lymphoma. (Funded by Pharmacyclics and others; ClinicalTrials.gov number, NCT01236391.)
FDA expands approved use of Imbruvica for chronic lymphocytic leukemia
Source: FDA
For Immediate Release
July 28, 2014
Release
The U.S. Food and Drug Administration today expanded the approved use of Imbruvica (ibrutinib) to treat patients with chronic lymphocytic leukemia (CLL) who carry a deletion in chromosome 17 (17p deletion), which is associated with poor responses to standard treatment for CLL. Imbruvica received a breakthrough therapy designation for this use.
The FDA is also approving new labeling to reflect that Imbruvica’s clinical benefit in treating CLL has been verified. In February 2014, Imbruvica received accelerated approval to treat CLL based on its effect on overall response rate. New clinical trial results examining progression-free survival and overall survival have confirmed the drug’s clinical benefit.
A type of non-Hodgkin lymphoma, CLL is a rare blood and bone marrow disease that usually gets worse slowly over time, causing a gradual increase in white blood cells called B lymphocytes, or B cells. The National Cancer Institute estimates that 15,720 Americans will be diagnosed and 4,600 will die from CLL in 2014. Imbruvica works by blocking the enzyme that allows cancer cells to grow and divide.
“We continue to see advances in the availability of therapies to treat chronic lymphocytic leukemia, especially for difficult-to-treat patient populations,” said Richard Pazdur, M.D., director of the Office of Hematology and Oncology Products in the FDA’s Center for Drug Evaluation and Research. “Imbruvica is the fourth drug approved to treat CLL that received a breakthrough therapy designation, reflecting the promise of the breakthrough therapy designation program and demonstrating the FDA’s commitment to working cooperatively with companies to expedite the development, review and approval of these important new drugs.”
The other three drugs approved to treat CLL that received breakthrough designations are Gazyva (obinutuzumab) in November 2013, Arzerra (ofatumumab) in April 2014 and Zydelig (idelalisib) in July 2014. Imbruvica’s application for accelerated approval to treat CLL did not receive breakthrough therapy designation.
Today’s approval actions for Imbruvica are based on a clinical study of 391 previously treated participants, 127 of whom had CLL with 17p deletion. Participants were randomly assigned to receive Imbruvica or Arzerra until disease progression or side effects became intolerable.
The trial was stopped early for efficacy after a pre-planned interim analysis showed Imbruvica-treated participants experienced a 78 percent reduction in risk of disease progression or death (progression-free survival). Results also showed a 57 percent reduction in risk of death (overall survival) in participants treated with Imbruvica. Of the 127 participants who had CLL with 17p deletion, those treated with Imbruvica experienced a 75 percent reduction in risk of disease progression or death.
The most common side effects associated with Imbruvica observed in the clinical study include low levels of platelets in the blood (thrombocytopenia), a decrease in infection-fighting white blood cells called neutrophils (neutropenia), diarrhea, low red blood cells (anemia), fatigue, pain in the muscles and bones (musculoskeletal pain), upper respiratory tract infection, rash, nausea and fever (pyrexia).
Imbruvica’s new use is being approved more than two months ahead of the product’s prescription drug user fee goal date of Oct. 7, 2014, the date the FDA was scheduled to complete review of the drug application. The FDA reviewed Imbruvica’s application for this new use under the agency’s priority review program, which provides for an expedited review of drugs that are intended to treat a serious disease or condition and, if approved, would offer significant improvement compared to marketed products.
Imbruvica also received accelerated approval in November 2013 for the treatment of patients with mantle cell lymphoma who have received at least one prior therapy. Clinical studies to verify and describe Imbruvica’s clinical benefit in mantle cell lymphoma are ongoing.
Imbruvica is co-marketed by Pharmacyclics, based in Sunnyvale, Calif., and Janssen Biotech, based in Horsham, Penn.
The FDA, an agency within the U.S. Department of Health and Human Services, protects the public health by assuring the safety, effectiveness, and security of human and veterinary drugs, vaccines and other biological products for human use, and medical devices. The agency also is responsible for the safety and security of our nation's food supply, cosmetics, dietary supplements, products that give off electronic radiation, and for regulating tobacco products.
Gerelateerde artikelen
- Pirtobrutinib, een niet-covalente BTK remmer, blijkt effectief bij zwaar voorbehandelde patiënten met chronische lymfatische leukemie (CLL) of kleincellig lymfatisch lymfoom (SLL) die eerder een covalente BTK remmer hadden gehad
- Reviewstudie beschrijft hoe je het beste patienten met CLL = Chronische Lymfatische Leukemie kunt diagnosteren en welke behandelingen het beste zijn te gebruiken in verschillende stadia van de ziekte.
- Venetoclax plus rituximab geeft ook bij jonge en fitte patiënten met chronische lymfatische leukemie en zelfs bij ongemuteerde IGHV veel complete remissies
- acalabrutinib als monotherapie verbeterde progressievrije overleving aanzienlijk met lager bijwerkingenprofiel dan idelalisib + rituximab of bendamustine + rituximab bij gevorderde CLL - chronische lymfatische leukemie
- Ibrutinib geeft veel betere resultaten op ziekteprogressievrije overleving (87 vs 74 procent) dan bendamustine plus rituximab bij onbehandelde oudere CLL patienten. Rituximab lijkt zinloos naast ibrutinib
- Man - 48 jaar - met al 20 jaar Chronische Lymfatische Leukemie (CLL) weigert chemo en bereikt een langdurige en duurzame remissie na behandeling met Epigallocatechin-3-gallate, een extract van groene thee. copy 1
- BCL-2 remmer - ABT-199/GDC-0199 geeft spectaculaire resultaten bij vergevorderde zwaar voorbehandelde CLL -Chronische Lymfatische Leukemie met alsnog 23 procent totale remissies van minimaal 2 jaar
- Ibrutinib geeft veel betere ziektevrije tijd (plus 45 procent) in vergelijking met rituximab bij recidief van chronische lymfatische leukemie en SLL - lymfklierkanker
- Ibrutinib aanvullend op Bendamustine en Rituximab verbetert progressievrije ziekte en overall overleving met tientallen procenten bij Chronische Lymfatische Leukemia en recidief van lymfklierkanker met kleine tumoren copy 1
- Ibrutinib - Tyrosine kinase (BTK) remmer PCI 32.765 - Ibrutinib zorgt voor langere ziektevrije tijd met veel minder bijwerkingen bij patiënten met CLL - chronische lymfatische leukemie bevestigen nieuwe studies copy 1
- Idelalisib naast rituximab zorgt voor significant langere overleving en progressievrije tijd bij patienten met CLL - chronische lymfatische leukemie waarvoor chemo niet meer mogelijk was
- Groene thee extract zorgt binnen enkele maanden voor significante remissie bij CLL patienten (Chronische Lymfatische Leukemie) . Nieuwe fase II studie bevestigt eerdere goede resultaten. copy 1
- Ofatumumab door FDA goedgekeurd als medicijn voor patienten met CLL - Chronische Lymfatische Leukemie, ongevoelig geworden voor fludarabine en alemtuzumab.
- Combinatiebehandeling van fludarabine en alemtuzumab geeft significant langere ziektevrije tijd en betere overleving voor eerder behandelde CLL patienten
- Rituximab naast Fludarabine en cyclophosphamide geeft significant betere resultaten op ziektevrije tijd en op overleving bij CLL en wordt eerste lijns.
- CLL - Chronische Lymfatische Leukemie: een overzicht



Plaats een reactie ...
Reageer op "Ibrutinib - Tyrosine kinase (BTK) remmer PCI 32.765 - Ibrutinib zorgt voor langere ziektevrije tijd met veel minder bijwerkingen bij patiënten met CLL - chronische lymfatische leukemie bevestigen nieuwe studies copy 1"