Aan dit artikel is vele uren gewerkt, opzoeken vertalen enz. Misschien wilt u ons ondersteunen met een donatie om kanker-actueel te laten blijven bestaan. Wij zijn volledig afhankelijk van donaties en giften want krijgen geen subsidie enz. Elk bedrag , hoe klein ook, is welkom. Uw donatie is in principe aftrekbaar voor de belasting want wij hebben een ANBI status Klik hier voor het doen van een al of niet anonieme donatie.
8 oktober 2014: In the Lancet is inmiddels ook het studierapport gepubliceerd van onderstaande studie: Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial
Het abstract uit the Lancet heb ik onderaan toegevoegd.
12 juni 2014: Bron: NCI - National Cancer Institute (http://www.cancer.gov/clinicaltrials/search/view?cdrid=673213&version=HealthProfessional)
Een combinatie behandeling van Olaparib plus Cedinarib is zeer effectief en verdubbelt progressievrije overleving bij vergevorderde eierstokkanker van 9,2 maanden naar 17,7 maanden in vergelijking met alleen olaparib of andere vergelijkbare medicijnen. Deze resultaten zijn opgemaakt maart 2014, maar kunnen nog beter worden omdat de studie nog niet is afgerond.
Dit blijkt uit een fase I/II studie uitgevoerd aan het Dana-Farber Cancer Institute, Boston met geld van het onafhankelijke NCI - National Cancer Institute. Het abstract werd gepresenteerd op ASCO 2014 door hoofdonderzoekster Joyce Liu, MD, MPH en medisch oncologe Susan F. Smith, MD.
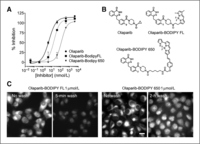
Figure 1.
Molecular properties and cellular imaging. A, the measured inhibitory concentrations of the three PARP inhibitors with the structure shown in B. C, in vitro images of olaparib-BODIPY FL and olaparib-BODIPY 650 show similar patterns of uptake. Before washing, the majority of the probe is located in the perinuclear endoplasmic reticulum, and, after washing, the nuclear signal (with higher PARP concentrations in the nucleolus) is more prominent. The kinetics of distribution are significantly different between the two probes, with the olaparib-BODIPY 650 rates around 10 times slower. The ratio of uptake in the ER to the nucleus before washing is also much higher with the olaparib-BODIPY 650 probe. The contrast is identical for olaparib-BODIPY FL before and after the wash, but the contrast was increased after 2 hours of washing to show the nuclear-specific staining, which is much lower than the perinuclear signal before washing (Supplementary Fig. S2). Scale bar, 20 μm.
Ook uit deze studie blijkt dat testen van bepaalde biomarkers, expressie van bepaalde eiwitten, zinvol is. Vooral BRCA gen mutaties spelen hierin een belangrijke rol. Ook vrouwen met borstkanker met BRCA mutaties kunnen deelnemen aan deze studie. Onderaan dit artikel staat het studieprotocol met toelatingseisen.
Uit deze studie blijkt dat bepaalde eiwitten ervoor zorgen dat DNA schade niet wordt hersteld waardoor vrouwen met eierstokkanker steeds weer een recidief krijgen ondanks de gevoeligheid voor chemo (cisplatin en carboplatin bv.). Met de combinatie van olaparib, een zogeheten PARP-remmer (gericht op juist die eiwitten die reparatie van DNA voorkomen) en cedinarib, een VEGFR remmer (remt het eiwit dat verantwoordelijk is voor het aanmaken van nieuwe bloedvaten) blijkt dat met chemo voorbehandelde patienten met eierstokkanker, maar desondanks progressie van hun ziekte vertoonden, dat juist die combinatie behandeling zeer effectief blijkt te zijn. Bijna een verdubbeling van progrssievrije ziekte van 9,2 maanden naar 17,7 maanden is volgens de onderzoekers een absolute doorbraak naar een betere controle van eierstokkanker.
Hoe snel het kan gaan bljkt wel uit het verloop van deze studie die pas 4 jaar geleden werd opgezet, startend met laboratorium studies en nu 4 jaar later al voor deze resultaten zorgt.. In het laboratorium was gezien dat de combinatie behandeling wel eens succesvol zou kunnen zijn. Een fase I studie bevestigde dit en direct daarop is een fase II studie opgezet met 90 patiënten met vergevorderde eierstokkanker die chemoresistant waren en/of een recidief vertoonden nadat chemo wel was aangeslagen. Nu wordt de studie dus uitgebreid naar twee fase III studies, waarbij zoals gezegd ook vrouwen met BRCA positieve mutaties aan kunnen deelnemen.
Studieopzet:
In de Verenigde Staten worden jaarlijks ca. 22.000 gevallen van eierstokkanker nieuw gediagnosticeerd. Vijfenzeventig procent van de kankers worden geclassificeerd als een zogeheten hooggradig sereuze type, wat betekent dat deze vrouwen al een gevorderde vorm van eierstokkanker hebben bij de diagnose en zelden nog curatief - genezend te behandelen zijn.
Van de patiënten met een hooggradige vorm van eierstokkanker reageert ongeveer driekwart van de patiënten op de eerstelijns behandeling met bepaalde chemo combinaties zoals cisplatin of carboplatin, maar bij bijna iedereen zal er vroeg of laat een recidief optreden en is een pallatieve follow-up behandeling nodig.
Voor deze studie werden patiënten onderverdeeld in twee categorieën op basis van voorafgaande behandelingen en hoe zij hadden gereageerd op platina bevattende chemotherapie:
- 1. Platinum-gevoelig - dit zijn patiënten die het meeste baat hadden/hebben bij de zogeheten Poly ADP-ribose polymerase (PARP) remming. PARP remmers, zoals olaparib zijn gerichte geneesmiddelen die een enzym - eiwit betrokken bij vele functies in de cel, zoals het herstel van DNA schade, blokkeren.
- 2. Platinum-Resistant - dit zijn patiënten bij wie de ziekte al binnen zes maanden na voltooiing van eerstelijns chemotherapie (met name cisplatin of carboplatin erbij) ziekte progressie vertoonde en/of een recidieff liet zien. Deze vrouwen zijn over het algemeen minder ontvankelijk voor verdere behandelingen en hebben niet goed gereageerd op PARP-remmers. Deze vrouwen worden meestal behandeld met geen platina bevattende andere vormen van chemotherapie, met of zonder toevoeging van een angiogenese remmer zoals bv. avastin - bevacizumab.
Op basis van laobratorium studies waaruit bleek dat een anti-angiogese remmer - bloedvatenremmer - genaamd cediranib (VEGRF remmer) en olaparib, (een PARP-remmer), indien samen gegeven elkaar kunnen versterken in effectiviteit, werd een fase I studie opgezet die aantoonde dat ook in de eerste fase I studie deze combinatietherapie van cediranib en olaparib goed aansloeg met minimale bijwerkingen.
Vervolgens werden voor een fase II studie 90 patiënten uit negen verschillende ziekenhuizen gerandomiseerd ingedeeld in 2 groepen. Patiënten, gemiddelde leeftijd was 58, werden van oktober 2011 tot juni 2013 opgenomen in de studie.
Patiënten uit groep A krijgen oraal in te nemen een capsule met olaparib (400 mg tweemaal per dag) en de patiënten uit groep B krijgen een combinatie van de twee geneesmiddelen, oraal in te nemen (200 mg olaparib in capsule vorm tweemaal daags en 30 mg cediranib eenmaal per dag). De 2 studiegroepen werden gestratificeerd beoordeeld naar BRCA genmutatie status en het al of niet eerder hebben gekregen van anti-angiogenese remmers. Het BRCA gen is een van de meest voorkomende gemuteerde genen bij borstkanker.
Studieresultaten:
Vanaf maart 2014, was de mediane progressievrije overleving 9,2 maanden voor olaparib alleen
en 17,7 maanden voor de combinatie behandeling. Een statistisch significant verschil. Bijwerkingen waren hoger voor patiënten in de combinatiegroep. Vermoeidheid, diarree en verhoogde bloeddruk waren de meest voorkomende bijwerkingen, die echter allemaal heel goed beheersbaar waren volgens de onderzoekers.
"Van bijzonder belang is ook het feit dat beide medicijnen gebruikt in deze studie in de vorm van pillen zijn en kan een alternatief bieden voor de veel belastendere intraveneuze chemotherapie," aldus Percy Ivy, MD, associate chief van de NCI Investigational Drug Branch. "Daarom kan deze combinatietherapie overal worden gebruikt waar patiënten veilig kunnen worden gecontroleerd op de bijwerkingen van olaparib en cediranib, zoals diarree en te hoge bloeddruk."
Gebaseerd op deze resultaten, zijn twee fase 3 studies gepland voor platinum gevoelige en platina resistente eierstokkankerpatiënten door het nieuwe NCI - National Cancer Trial Netwerk, de NRG Oncology Group (voorheen 3 coöperatieve groepen: de National Surgical Adjuvant Breast en Bowel Project (NSABP), de Radiation Therapy Oncology Group (RTOG), en de gynaecologische oncologie Group (GOG).
Het persbericht over deze studie: Clinical trial analysis suggests drug combination may be highly effective in recurrent ovarian cancer kunt u lezen op de website van het NCI of hieronder en bovenstaande vertaling is daarop gemaakt.
Het studieprotocol: Cediranib Maleate and Olaparib in Treating Patients With Recurrent Ovarian, Fallopian Tube, Peritoneal Cancer, or Triple-Negative Breast Cancer staat in Clinical trials met ook aan welke eisen u als patiënt moet voldoen voor deelname. En zoals gezegd ook vrouwen met borstkanker met HER2 negatieve status en BRCA positieve status kunnen deelnemen aan deze studie.
Ik weet dat ook in België en Nederland vrouwen kunnen deelnemen aan een studie met deze combinatie behandeling maar vraag dat aan uw behandelend arts.
Clinical trial analysis suggests drug combination may be highly effective in recurrent ovarian cancer
Significant improvement with the use of a combination drug therapy for recurrent ovarian cancer was reported at the annual meeting of the American Society of Clinical Oncology (ASCO) meeting in Chicago today (late breaking abstract #5500). This is the first ovarian cancer study to use a combination of drugs that could be taken orally. The drugs were tested in a phase I combination study followed by a randomized phase 2 trial sponsored by the National Cancer Institute (NCI), part of the National Institutes of Health.
The trial compared the activity of a combination of the drug olaparib (which blocks DNA repair) and the blood vessel inhibitor drug cediranib, vs. olaparib alone. Trial results showed a near doubling of progression-free survival benefit (the length of time during and after treatment that the cancer did not get worse) for the combination therapy over use of the single drug alone.
“The findings of this study are exciting because they support the idea that combining these two targeted oral therapies results in significant activity in ovarian cancer, more so than olaparib alone,” said Joyce Liu, M.D., M.P.H., the lead investigator and medical oncologist at the Susan F. Smith Center for Women's Cancers  at Dana-Farber Cancer Institute
at Dana-Farber Cancer Institute  , Boston. “We are looking forward to further exploring this combination in ovarian cancer and potentially increasing effective treatment options for our patients with this cancer.”
, Boston. “We are looking forward to further exploring this combination in ovarian cancer and potentially increasing effective treatment options for our patients with this cancer.”
Over 22,000 cases of ovarian cancer are diagnosed annually in the United States. Seventy-five percent of the cancers are classified as high-grade serous type, the women have more advanced disease at diagnosis, and their tumors are more aggressive. Of this high-grade type, about three-quarters of patients respond to initial treatment but nearly all will recur and need follow-up treatment. That treatment will be based on how the cancers have responded to previous therapies and are broken down into two categories based on patients’ responses to chemotherapy regimens that include platinum:
- Platinum-Sensitive – these are patients most likely to benefit from Poly ADP-Ribose Polymerase (PARP) inhibition. PARP inhibitors, such as olaparib, are targeted drugs that block an enzyme involved in many functions in the cell, including the repair of DNA damage.
- Platinum-Resistant – these are patients whose disease recurred within six months of completion of conventional chemotherapy (using the drugs cisplatin or carboplatin) and are generally less responsive to subsequent treatments and have not responded as well to PARP inhibitors. They are currently treated with non-platinum chemotherapy, single-agents, with or without addition of the blood vessel inhibitor drug called bevacizumab.
An anti-angiogenic agent, or blood vessel inhibitor called cediranib (which inhibits a protein known as VEGFR) and olaparib, a PARP inhibitor, are each clinically active in recurrent ovarian cancer. Preclinical laboratory studies suggest these agents add to and enhance the activity of each other, and an early phase 1 study showed that the combination of cediranib and olaparib was well-tolerated with minimal side effects.
For this reason, 90 patients from nine centers were randomly assigned to one of two study arms for the phase II clinical trial: the first taking capsules of olaparib (400 milligrams twice daily) and the other taking a combination of the two drugs (200 mg olaparib in capsule form twice daily and 30 mg of cediranib by tablets once daily). The study arms were stratified by BRCA gene mutation status and receipt of prior anti-angiogenic therapy. The BRCA gene is one of the most commonly mutated genes in breast cancer.
Patients, whose median age was 58, were enrolled from October 2011 to June 2013. As of March 2014, median progression-free survival was 9.2 months for olaparib and 17.7 months for the combination therapy, which is a significant advantage. The overall rate of toxicity was higher for patients on the combination therapy. Fatigue, diarrhea, and hypertension were the most common toxic effects, all of which were manageable.
“Of particular note is the fact that both drugs used in this trial are in pill form and could offer an alternative to intravenous chemotherapy,” said Percy Ivy, M.D., associate chief of NCI’s Investigational Drug Branch. “Therefore, this combination therapy could be used anywhere in the world where patients can be safely monitored for the side-effects of olaparib and cediranib, such as diarrhea and hypertension.”
Based on these results, two phase 3 trials are being planned for platinum-sensitive and platinum-resistant ovarian cancer patients by one of NCI’s new National Cancer Trial Network Groups, the NRG Oncology Group (formerly 3 cooperative groups: the National Surgical Adjuvant Breast and Bowel Project (NSABP), the Radiation Therapy Oncology Group (RTOG), and the Gynecologic Oncology Group (GOG).
This trial was funded by NCI and received supplementary funds from the Recovery Act.
###
Reference: Liu, JF, et al. A randomized phase 2 trial comparing efficacy of the combination of the PARP inhibitor olaparib and the anti-angiogenic cediranib against olaparib alone in recurrent platinum-sensitive ovarian cancer. NCT 01116648. ASCO late breaking abstract #5500. http://www.cancer.gov/clinicaltrials/search/view?cdrid=673213&version=HealthProfessional
The National Cancer Institute (NCI) leads the National Cancer Program and the NIH effort to dramatically reduce the prevalence of cancer and improve the lives of cancer patients and their families, through research into prevention and cancer biology, the development of new interventions, and the training and mentoring of new researchers. For more information about cancer, please visit the NCI website at http://www.cancer.gov or call NCI's Cancer Information Service at 1-800-4-CANCER (1-800-422-6237).
NIH, the nation's medical research agency, includes 27 Institutes and Centers and is a component of the U.S. Department of Health and Human Services. NIH is the primary federal agency conducting and supporting basic, clinical, and translational medical research, and is investigating the causes, treatments, and cures for both common and rare diseases. For more information about NIH and its programs, visit http://www.nih.gov.
Dana-Farber Cancer Institute  , a principal teaching affiliate of Harvard Medical School, is world-renowned for its leadership in adult and pediatric cancer treatment and research. Designated as a comprehensive cancer center by the National Cancer Institute, it is one of the largest recipients among independent hospitals of NCI and National Institutes of Health grant funding. For more information, go to www.dana-farber.org
, a principal teaching affiliate of Harvard Medical School, is world-renowned for its leadership in adult and pediatric cancer treatment and research. Designated as a comprehensive cancer center by the National Cancer Institute, it is one of the largest recipients among independent hospitals of NCI and National Institutes of Health grant funding. For more information, go to www.dana-farber.org  .
.
Patients with platinum-sensitive recurrent serous ovarian cancer with a BRCA mutation have the greatest likelihood of benefiting from olaparib treatment.
The Lancet Oncology, Volume 15, Issue 8, Pages 852 - 861, July 2014
doi:10.1016/S1470-2045(14)70228-1![]()
Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial
Summary
Background
Methods
Findings
Interpretation
Funding
Gerelateerde artikelen
- HER2-vaccinatie in combinatie met een anti-CD27 monoklonaal antilichaam + anti-PD-1 mAb-behandeling houdt alle patienten met uitgezaaide borstkanker in laatste stadium van hun leven al 18 jaar in leven
- Borstkankerpatiente en wetenschapster Beate Halassy maakte in haar eigen laboratorium twee oncolytische virussen en behandelde zichzelf daarmee succesvol in 2020.
- Pembrolizumab geeft betere overall overleving op 5 jaar voor patienten met beginnende niet uitgezaaide borstkanker in vergelijking met chemotherapie en placebo
- Pertuzumab plus trastuzumab geeft zelfde 2 jaars overall overleving met of zonder chemotherapie bij patienten met uitgezaaide borstkanker met Her2 positief
- Pertuzumab - Perjeta door FDA goedgekeurd als eerstelijns behandeling immuuntherapie bij operabele borstkanker HER-2 positief na uitstekende resultaten uit fase 3 APHINITY studie
- Stereotactische lichaamsbestraling plus plaatselijke injectie met valacyclovir een medicijn tegen herpesvirus plus pembrolizumab geeft verdubbeling van overall overleving bij zwaar voorbehandelde patienten met uitgezaaide triple negatieve borstkanker.
- Immuuntherapie met combinatiebehandeling van nivolumab en ipilimumab zou voor patienten met zogeheten metaplastische borstkanker een behandelingsoptie kunnen zijn blijkt uit kleinschalige studie
- Atezolizumab + nab-paclitaxel chemotherapie als eerstelijns behandeling voor triple negatieve borstkanker met PD-L1-positieve expressie geeft uitstekende resultaten op overall overleving met 10 maanden meer
- HER2-peptidevaccins, GP2 en AE37, lijken bij borstkankerpatiënten goede opties om een recidief te voorkomen.
- FDA verleent versnelde goedkeuring aan pembrolizumab voor lokaal terugkerende inoperabele of uitgezaaide triple-negatieve borstkanker
- Durvalumab met Olaparib en Paclitaxel geeft 17 procent betere complete remissies in vergelijking met alleen chemo bij vrouwen met borstkanker stadium II / III hoog risico, maar ook bij HER2 positief en triple negatief copy 1
- sTILs - tumor infiltrating lymphocytes aanwezig na chemo in beginnende borstkanker triple negatief voorspellen aanslaan van behandeling en geeft superieure overall overleving op drie jaar
- Vrouw met uitgezaaide hormoongevoelige borstkanker (HR-pos) komt in een duurzame complete remissie met immuuntherapie met anti-PD medicijn en TIL - tumor Infiltrating lymfocyten gericht op 4 specifieke mutaties copy 1
- ASCO 2017: I-SPY 2 Trial: Combination of Pembrolizumab Plus Standard Neoadjuvant Therapy in High-Risk Breast Cancer
- Immuuntherapie voor borstkanker in alle stadia maar ook als preventie in eerstelijns en tweede lijns voor borstkanker komt steeds dichterbij. Aldus Elizabeth A. Mittendorf, MD, PhD copy 1
- Immuuntherapie tegen borstkanker (MUC1) met injecties van oxidized mannan-MUC1 geeft een 100% resultaat in het voorkomen van een recidief binnen vijf jaar bij vrouwen met borstkanker stadium II
- Nivolumab: Immuuntherapie in fase II studie voor patienten met triple negatieve borstkanker met nivolumab gestart in Antoni van Leeuwenhoek ziekenhuis per 3 september 2015. copy 1
- Vaccin GP2 naast herceptin geeft significant betere resultaten na 3 jaar dan alleen herceptin bij Her2 positieve borstkanker
- Olaparib plus cedinarib lijkt doorbraak bij controle van vergevorderde eierstokkanker en verdubbelt progressievrije overleving van 9,2 maanden naar 17,7 maanden copy 1
- Gc-MAF een vitamine D verbindend eiwit werkt uiterst effectief (100% genezing bij totaal 8 borstkankerpatienten) als vernietiging en bescherming tegen terugkeer van borstkanker.
- Immuuntherapie: Nieuw vaccin - AE37 - gericht op HER2 expressie lijkt een recidief van borstkanker te kunnen voorkomen bij ruim de helft van de borstkankerpatiënten
- Immuuntherapie met donor natural T-killer cells doodt ook chemo resistente borstkankercellen - tumorstamcellen - en werkt volledig genezend toont een Nederlandse dierstudie aan
- Immuuntherapie met Her2-Neu peptides zorgt voor significant minder recidieven en beduidend minder overlijden bij borstkankerpatienten. 12,5% t.o. 41,7%.
- Immuuntherapie met injecties van MUC1 bij vrouwen met erfelijke BRCA1 of BRCA2 mutaties kan kans op ontwikkeling van borstkanker significant verkleinen. Aldus een gerandomiseerde studie uitgevoerd in de VU Amsterdam.
- Immuuntherapie bij borstkanker, een overzicht





Plaats een reactie ...
Reageer op "Olaparib plus cedinarib lijkt doorbraak bij controle van vergevorderde eierstokkanker en verdubbelt progressievrije overleving van 9,2 maanden naar 17,7 maanden copy 1"