20 augustus 2016: Bron: Nu.nl en Nature doi:10.1038/nature19081 Received Accepted Published online
"Onze bevindingen kunnen het kankeronderzoek enorm vooruithelpen", zegt co-auteur Bernard Thienpont tegen Nu.nl. "Door bijvoorbeeld de zuurstoftoevoer naar tumoren goed te monitoren, kunnen we voorspellingen maken over het verloop en de mogelijke behandelingen van kanker."
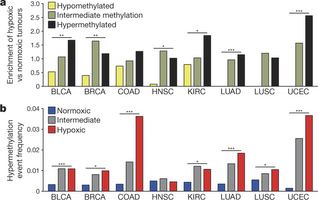 Grafiek uit studieverslag in Nature
Grafiek uit studieverslag in Nature
Observed and expected number of hypoxic versus normoxic tumours in 3 methylation clusters for 1,000 CpGs hypermethylated in tumour versus normal tissue. b, Percentage of hypermethylation events in promoters of frequently hypermethyla…
De wetenschappers onderzochten het proces van hypermethylering in data van ca. 3000 kankerpatiënten. Hypermethylering is een proces waarbij tumoren relatief snel groeien, vaak ondanks behandelingen.
"Onze studie toont aan dat zuurstoftekort een belangrijke omgevingsfactor is voor hypermethylering. Zuurstoftekort verklaart zelfs tot de helft van alle gevallen van hypermethylering in tumoren", aldus co-onderzoeker Diether Lambrechts tegen Nu.nl
Het volledige studieverslag: Tumour hypoxia causes DNA hypermethylation by reducing TET activity
is te lezen op de website van nature.
Hier het abstract van de studie met aantal belangrijke grafieken en foto's:
In patients, tumour suppressor gene promoters are markedly more methylated in hypoxic tumour tissue, independent of proliferation, stromal cell infiltration and tumour characteristics. Our data suggest that up to half of hypermethylation events are due to hypoxia, with these events conferring a selective advantage
Tumour hypoxia causes DNA hypermethylation by reducing TET activity
- Nature
- doi:10.1038/nature19081
- Received
- Accepted
- Published online
Abstract
Hypermethylation of the promoters of tumour suppressor genes represses transcription of these genes, conferring growth advantages to cancer cells. How these changes arise is poorly understood. Here we show that the activity of oxygen-dependent ten-eleven translocation (TET) enzymes is reduced by tumour hypoxia in human and mouse cells. TET enzymes catalyse DNA demethylation through 5-methylcytosine oxidation. This reduction in activity occurs independently of hypoxia-associated alterations in TET expression, proliferation, metabolism, hypoxia-inducible factor activity or reactive oxygen species, and depends directly on oxygen shortage. Hypoxia-induced loss of TET activity increases hypermethylation at gene promoters in vitro. In patients, tumour suppressor gene promoters are markedly more methylated in hypoxic tumour tissue, independent of proliferation, stromal cell infiltration and tumour characteristics. Our data suggest that up to half of hypermethylation events are due to hypoxia, with these events conferring a selective advantage. Accordingly, increased hypoxia in mouse breast tumours increases hypermethylation, while restoration of tumour oxygenation abrogates this effect. Tumour hypoxia therefore acts as a novel regulator of DNA methylation.
At a glance
Plaats een reactie ...
1 Reactie op "Zuurstof tekort bevordert groei kankercellen. Toevoeging van zuurstof - ozontherapie - kan groei van tumorcellen remmen of zelfs tegengaan"
Gerelateerde artikelen
- Lees hier hoe de Vereniging tegen Kwakzalverij, VtdK, de weg helemaal is kwijtgeraakt afgelopen jaren. Een overzicht van artikelen en publicaties
- Academische uitgevers aangeklaagd wegens uitbuiting van wetenschappers. Uitgevers verdienden in 2023 miljarden aan publicaties die uitgevoerd zijn met belastinggeld
- Yvan Wolffers overlijdt aan de gevolgen van prostaatkanker op 7 oktober 2022
- VITALITY OF LIFE BY PERSONALIZED MEDICINE Bruggen bouwen in het complementaire veld. 2 daags jubileumcongres om het 40-jarig bestaan van de NatuurApotheek en het 20+2 jarig bestaan van de Hahnemann Apotheek op 2 en 3 september 2022
- Ministerie van Economische Zaken en Klimaat (EZK) liet advies minder vlees te eten bewust weg uit klimaatcampagne, zo ontdekte Stichting Wakker Dier
- Nieuwe kankermedicijnen worden in Europa (EMA) veel later goedgekeurd dan in Amerika (FDA) en kost tienduizenden levensjaren.
- Wetenschappers van het Anthonie van Leeuwenhoek ziekenhuis zeggen met combinatiebehandeling (one-two-punch ) van reeds bestaande medicijnen de sleutel tot genezende behandeling van kanker te hebben gevonden
- Nieuw NANO-Vaccin, 2 natuurlijke peptiden , aminozuren verpakt in nanodeeltjes voorkomt melanomen en uitzaaiingen bij melanomen en blijkt als immuuntherapie uitstekend te werken
- Whole genome sequencing: toekomst van de kankerdiagnostiek? AvL start studie samen met UMC Utrecht
- Surviving terminal cancer: kunnen overlevenden van een hersentumor helpen kanker te overwinnen? Drie mannen overwonnen hun hersentumor - GBM - en 2 ervan zijn al 15 en 20 jaar vrij van kanker met eigen cocktail van bewezen niet-toxische middelen.
- AMC start studieproject EIGEN ONDERZOEK waarbij 500 patienten met darmklachten en chronische vermoeidheid zelf hun ervaringen met probiotica en beweging enz. bijhouden via een app.
- Chemo stimuleert juist kankergroei en uitzaaiïngen door verhoogde productie van het eiwit WNT16B dat ook grote rol speelt bij wondheeling
- Kanker opsporen binnen 20 minuten en een kant en klaar behandelingsvoorstel wordt binnen drie jaar mogelijk met nieuw apparaat gebaseerd op nanotechnologie.
- Effecten van medicijnen en behandelingen bij 52 aandoeningen waaronder kanker moeten volgens het Zorginstituut vermeld worden in persoonlijke medische dossiers
- vorinostat heft resistentie van kankercellen op bij melanomen en lijkt oplossing voor dure medicijnen aldus Rene Bernards van het NKI. Vorinostat blijkt ook bij recidief van zwaar voorbehandelde multiple myeloma met 94 procent bijzonder effectief
- Keer diabetes om wint zinnige zorg award voor voedingsprogramma voor diabetici
- E-sigaret blijkt 95 procent minder schadelijk dan tabak roken en stimuleert rokers te stoppen. Echter tieners lijken er juist door gestimuleerd te worden te beginnen met roken
- Zorginstituut ziet verdere verbetering van behandelingen van niercelkanker met nieuwe medicijnen en doet aanbevelingen in een rapport aan Minister Bruins.
- Bepaalde darmbacteriën kunnen de effectiviteit van immunotherapie met anti-PD medicijnen verhogen bij de behandeling van melanomen
- Mammografie zorgt nauwelijks voor vermindering van risico op overlijden aan gevorderde borstkanker maar wel voor veel meer onnodige behandelingen door overdiagnose
- Vitamine C in combinatie met Doxycycline een antibiotica doden samen kankerstamcellen en lijkt nieuwe behandelingsoptie nagenoeg zonder bijwerkingen
- Antibiotica verminderen effectiviteit van immuuntherapie terwijl aanvullende microbiota de resultaten sterk verbeteren van immuuntherapie met anti-PD medicijnen
- Goedkeuring van nieuwe kankermedicijnen meestal gebaseerd op te weinig bewijs en geven in de praktijk slechts bij de helft kleine verbeteringen in mediane overleving.
- Biliscreen, een speciale app kan via een selfie van oog vroegtijdig alvleesklierkanker en aan geelzucht gerelateerde leveraandoeningen ontdekken.
- Nederlandse DRUP studie, waarbij behandelingen worden gegeven gebaseerd op DNA mutaties en receptorenexpressie geeft hoopvolle resultaten voor uitbehandelde kankerpatienten
- Immuuntherapeutische studies zoals gepresenteerd Op ASCO 2017 in Chicago 2 t/m/ 5 juni 2017
- Propranolol, een bloeddrukverlager, blijkt effectief geneesmiddel tegen angiosarcomen en is goedgekeurd als weesgeneesmedicijn voor onderzoek door Europese Commissie.
- Darmflora met gevarieerde bacterien geven betere resultaten voor immuuntherapie bij melanomen dan een minder gevarieerde darmflora.
- Zuurstof tekort bevordert groei kankercellen. Toevoeging van zuurstof - ozontherapie - kan groei van tumorcellen remmen of zelfs tegengaan
- Melkzuurbacterien - probiotica aanwezig in gezond borstweefsel beschermt vrouwen tegen borstkanker blijkt uit kleinschalige studie
- The quest for the cures of cancer, bekijk documentaire van oncologen, wetenschappers en patienten over natuurlijke geneeswijzen bij kanker
- Vader Pieter en zoon Bernard van Vollenhoven genezen van uitgezaaide melanoom en lymfklierkanker. Ook Jimmy Carter blijkt kankervrij. Bepalen geld en macht de kansen op genezen van kanker?
- Gepersonaliseerd vaccin voor immuuntherapie is de sleutel tot voorkomen en genezen van kanker ontdekt een team van wetenschappers.
- LUMC opent Nederlandse Donor Feces Bank (NDFB) - poepbank waar iedereen die gezond is zijn ontlasting kan doneren, welke gebruikt wordt voor herstel van darmflora bij zieke patienten.via neussonde
- In Nederland overlijden elk jaar de meeste mensen onder de 65 jaar aan kanker en Nederland staat tweede voor mensen ouder dan 65 jaar van heel Europa
- Dr. Nicolas Gonzalez sterft onder verdachte omstandigheden. Dr. Gonzalez is in 1 jaar de tijd de 10e complementair werkende arts die overlijdt door moord of onder verdachte omstandigheden
- Nieuwe aanpak van kanker gevonden door Amerikaanse tiener?
- PLEKHA7 een eiwit speelt cruciale rol in apoptose - zefldoding van kankercellen. Onderzoekers aan de Mayo Clinic ontdekken dat reparatie van PLEKHA7 vorming van tumoren kan voorkomen.
- Doorbraak in bestrijden van chronische pijn met de lichaamseigene ontstekingsremmende stof palmitoylethanolamide welke geen bijwerkiingen geeft
- Darmkankeronderzoek: de eerste resultaten gepresenteerd. Bij 1 op de 28 werd iets afwijkends gevonden
- ZONmw pleit in rapport voor meer integratie van alternatieve, complementaire, aanvullende middelen en behandelingen in de reguliere gezondheidszorg
- Nano-MRI met nanovloeistof ontdekt sneller uitzaaiingen in lymfklieren en kan behandeling van kanker sneller doen starten of juist aantonen dat behandelingen niet nodig zijn.
- Welke behandeling krijgt de patiente met dikke darmkanker uit de Wereld Draait Door van vanavond 8 oktober 2013?
- Nieuwe Tieten van Sacha Polak. is een persoonlijke en openhartige documentaire over wel of niet preventief haar borsten te laten verwijderen omdat.ze draagster is van het BRCA-1 gen
- Mamma waarom moet je naar het ziekenhuis? Nieuwe animaties en tekeningen voor peuters en kinderen die een ouder met kanker hebben op website van stichting Kankerspoken.
- Erasmus Medisch Centrum gaat onderzoek doen naar effecten van hyperthermie bij kanker als aanvulling op chemo of bestraling
- Injecties met 3-bromopyruvate (3-BrPA) in tumorweefsel zou effectiever werken dan operatie en chemo bij borstkanker..Deze antiglycolitic therapie beinvloed metabolisch proces in kankercel en leidt tot natuurlijke celdood
- Time released chemo toedienen via nanodeeltjes bij hersentumoren - glioma blastoma multiforme, verdubbelt overlevingstijd in dierstudies
- Op menselijke genen kan geen patent worden verkregen zo luidt het oordeel van het Hooggerechtshof in de Verenigde Staten. Op synthetische DNA-sequenties mag dit echter wel.
- In Nederland bestaat er grote ongelijkheid in gebruik van dure diagnostiek en behandelingen voor kankerpatienten, aldus prof. dr. Carin Uyl-de Groot.
- Botuitzaaiingen worden vaak veroorzaakt door stamcellen in het beenmerg, ontdekken wetenschappers.
- Nieuwe vorm van uitstrijkje zou vroegtijdig eierstokkanker, baarmoederkanker en baarmoederhalskanker ontdekken, beweren Amerikaanse onderzoekers
- BG-12 - dimethyl fumaraat - verbetert significant kwaliteit van leven en vermindert klachten van bepaalde vorm van MS - multiple sclerose (RR MS = de schubvorm van MS), aldus meta analyse van fase III studies.
- Darmkanker stijgt met 42 procent de laatste tien jaar. Wereld Kanker Onderzoek Fonds start groot internationaal onderzoek naar effecten van leefstijl en voeding op risico van darmkanker
- Voedingstoffen als medicijn: biochemische kaart van menselijk lichaam voltooid. Ziektes kunnen voorkomen worden door individueel voedingspatroon.
- Bloedtest kan bepalen of er chemo nodig is bij uitgezaaide borstkanker en darmkanker, aldus promotie onderzoek van Bianca Mostert

















Wat er nu door de universiteit van Leuven wordt vermeld is mijns inziens niets nieuws.
Al in 1927-1966 heeft Dr. Warburg uit Duitsland dit ontdekt en zelfs bewezen.
Citaat van hem: "Maar zelfs voor kanker is er maar één belangrijke oorzaak. Kort samengevat: De primaire oorzaak van kanker is de vervanging van de zuurstofademhaling in normale cellen door een fermentatie van suiker."
Anders gezegd: Krijgt een gezonde cel té weinig zuurstof dan veranderd deze cel uiteindelijk in een kankercel.
Om kanker te voorkomen moet men er dus voor zorgen dat de gezonde cellen voldoende zuurstof blijven krijgen.
En hier ligt volgens mij de oplossing tot het voorkomen van kanker.
Hier zou dus al lang veel meer kracht en inspanning aan gegeven moeten worden.
GENEZEN IS PRACHTIG, VOORKOMEN IS VEEL BETER.
Met vriendelijke groet, Gerard van Boekel.