Raadpleeg ook de literatuurlijsten niet-toxische stoffen en behandelingen specifiek bij 1 vorm van kanker of naast chemo, bestraling , operatie of stamceltransplantaties van arts-bioloog drs. Engelbert Valstar
13 december 2019: Bron: You Tube
Wie een film wil zien van kankerpatienten die vertellen over hun ervaringen met het RIGVIR virus kijkt naar deze You Tube film. Is wel gemaakt en geplaatst door de producent van het Rigvir virus maar zijn wel indrukwekkende ervaringsverhalen van de mensen waarvan sommigen na hun genezing van kanker de Mont Blanc beklommen:
https://www.youtube.com/watch?v=ig-fnY8624w&feature=youtu.be
Can cancer patients climb one of the highest peaks in Europe? Watch movie and find more information at https://www.virotherapy.eu and http://www.virotherapyfoundation.org/en/ Real cancer thrivers gathering from all around the world to attempt Mont Blanc, to overcome their physical and emotional challenges, tears, despair, and exhaustion and turn into joy, friendship and strength not only to fight their disease but live their lives to the fullest. The climb was supported by Aina Muceniece Virotherapy Foundation, organization named for the discoverer of Rigvir oncolytic virus and dedicated to stimulate oncolytic virotherapy development and availability of this cancer treatment for the cancer patients around the World.
5 november 2015: Bron: Melanoma Res. 2015 Oct; 25(5): 421–426. Published online 2015 Sep 3.
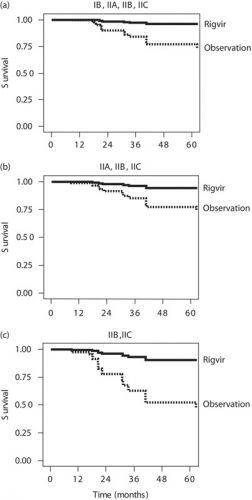
Het zogeheten oncolytische virus Rigvir geeft 5x minder kans om binnen 5 jaar aan operabele melanomen met stadia van IB t/m IIC te overlijden in vergelijking met een zoals in de richtlijnen voorgeschreven wait and see beleid, een observatiebeleid. Deze resultaten zijn statistisch significant: 4.39–6.57 minder kans te overlijden (P<0.05)
Van de patiënten met een melanoom stadium IIA, IIB en IIC bij aanvang van de studie bereikte ca. 35% meer de 5 jaars overleving dan de mensen uit de controlegroep.
Opvallend bij de grafiek is dat wie na 3,5 jaar ziektevrij is of nog leeft dat ook na 5,5 jaar zo is. De grafieklijn van progressie van de ziekte en overlijden daalt de eerste drie jaar gestaag in beide groepen, al wel beduidend minder snel in de Rigvir groep maar loopt bij alle patienten na ca. 3 jaar nagenoeg horizontaal door tot na de 5 jaar. Blijkbaar is er dan sprake van geen actieve kankercellen meer?
Opvallend ook dat de observatiegroep bestond uit patiënten met een minder ernstig stadium dan die in de behandelgroep. Dat verklaart ook dat grotere verschil tussen de beide groepen naargelang de ernst van de ziekte. Wie een ernstiger substatus had had minste kans te overlijden binnen 5 jaar dan wie een minder ernstige substadium had en daardoor in de observatiegroep terecht kwam.
Mooi is ook dat de behandeling met het Rigvir virus geen ersntige bijwerkingen gaf te zien.
Foto: Cox regression analysis plots of survival of melanoma patients following surgery. P is the statistical significance of the difference between the Rigvir (—) group and the observation according to current guidelines (observation) group (---)
Studieopzet en resultaten:
79 blanke patienten die een operatieve verwijdering hadden gehad van hun melanoom (waarvan de diagnose histologisch was bevestigd en in algemeen geldend stadium ingedeeld) werden opgenomen in de studie over een periode van 4 jaar (van januari 2008 tot december 2011. Alle patiënten waren klinisch vrij van kanker en waren ingedeeld in substadia IB, IIA, IIB and IIC naar de indeling van de American Joint Committee on Cancer (zie referenties 30,31).
Om een ziekteprogressie vast te stellen werden alle patiënten gevolgd voor een follow-up periode van minimaal drie maanden tot januari 2014. De overall overleving werd gemeten op 5 juni 2014 en geeft de situatie weer van 27 mei 2014.
Melanomen zijn ingedeeld in substadia van 0 to IV door het meten van de dikte van de tumor volgens Breslow, door aanwezigheid van ontstekingen, staat van kwaadaardighied en uitzaaiingen en door pathologische informatie (biopt) te verzamelen uit regionale lymfklieren. (Zie referenties: 30,31.)
Huidige richtlijnen adviseren geen behandeling na een operatie van een melanoom die ingedeeld zijn in stadium IB t/m/ IIA. Voor patiënten met substadia IIB en IIC zijn er drie opties volgens de geldende richtlijnen: deelnemen aan een klinische studie, observatie (wait and see beleid) en interferon. Omdat er geen strikte richtlijnen waren is als vierde optie het Rigvir virus aangeboden. Zo hebben 52 studiedeelnemers het Rigvir virus gekregen als behandeling en 27 werden geobserveerd volgens daarvoor officieel goedgekeurde geldende richtlijnen. De patiënten die interferon hadden gekregen zijn uitgesloten van deze studie analyse. Daarvoor waren er te weinig patiënten om daaraan een vergelijking te kunnen maken en conclusies te kunnen verbinden.
De behandeling met het Rigvir virus (N=52) werd gestart nadat de primaire tumor operatief was verwijderd en de wonden voldoende genezen. Eerst werd het Rigvir virus (2 ml) intramusculair regionaal toegediend drie dagen op rij. Na ongeveer vier weken werd deze behandeling herhaald, weer op drie achtereenvolgende dagen, en 4 weken later nog een keer. Dus binnen drie maanden werd drie keer drie dagen het Rigvir virus (2 ml.) toegediend. Daarna werd dezelfde behandeling (2ml Rigvir intramusculair) 1x per maand herhaald in het eerste jaar, in de eerste helft van het tweede jaar na de start van de behandeling 1x per 6 weken, in de tweede helft van het tweede jaar 1x per 2 maanden en elke drie maanden in het derde jaar. Rigvir wordt niet toegediend als er sprake is van een acute infectie.
Resultaten:
De overleving van de patiënten die het Rigvir virus hadden gekregen was statistisch significant langer (P<0.05) vergeleken met de groep patiënten die geen Rigvir virus hadden gehad. Het verschil was ook statistisch significant voor zowel alle patiënten als voor de subgroep van patiënten met substadia IIA t/m IIC. Gecorrigeerd naar leeftijd van de patiënt, sexe en substadium van de ziekte met de multivaribele Cox regressie analyse, de Hazard ratio - HR voor patiënten uit de observatiegroep versus Rigvir groep was 6.27 (P<0.005) voor alle patiënten, 4.39 (P<0.032) voor substadium IIA–IIC patienten en 6.57 (P<0.014) voor substadium IIB–IIC patiënten.
Er werden geen ersntige bijwerkingen gezien afgezien van wat koorts rondom de injectiedagen en in een enkel geval wat diarree en ontsteking op plaats van injectie. Maar geen enkle graad 3 of hogere bijwerkingen.
Conclusie:
Dit betekent dat de patiënten die behandeld waren met het Rigvir virus een ca. 5x lagere kans (range 4.39–6.57) op overlijden aan hun ziekte hadden binnen 5,5 jaar dan de patiënten die volgens de geldende richtlijnen een wait-and-see beleid volgden.
Het volledige studierapport: Adapted ECHO-7 virus Rigvir immunotherapy (oncolytic virotherapy) prolongs survival in melanoma patients after surgical excision of the tumour in a retrospective study is gratis in te zien.
Hier het abstract van de studie:
Rigvir is an oncolytic, nonpathogenic ECHO-7 virus that significantly prolongs survival in early-stage melanoma patients without any side effect.
Adapted ECHO-7 virus Rigvir immunotherapy (oncolytic virotherapy) prolongs survival in melanoma patients after surgical excision of the tumour in a retrospective study.
Abstract
An oncolytic, nonpathogenic ECHO-7 virus adapted for melanoma that has not been genetically modified (Rigvir) is approved and registered for virotherapy, an active and specific immunotherapy, in Latvia since 2004. The present retrospective study was carried out to determine the effectiveness of Rigvir in substage IB, IIA, IIB and IIC melanoma patients on time to progression and overall survival. White patients (N=79) who had undergone surgical excision of the primary melanoma tumour were included in this study. All patients were free from disease after surgery and classified into substages IB, IIA, IIB and IIC. Circulating levels of clinical chemistry parameters were recorded. Survival was analysed by Cox regression. Rigvir significantly (P<0.05) prolonged survival in substage IB-IIC melanoma patients following surgery compared with patients who were under observation (according to current guidelines). The hazard ratio for patients under observation versus treated with Rigvir was statistically significantly different: hazard ratio 6.27 for all, 4.39 for substage IIA-IIB-IIC and 6.57 for substage IIB-IIC patients. The follow-up period was not statistically different between both treatment groups. These results indicate that the patients treated with Rigvir had a 4.39-6.57-fold lower mortality than those under observation. In this study, there was no untoward side effect or discontinuation of Rigvir treatment. Safety assessment of adverse events graded according to NCI CTCAE did not show any value above grade 2 in Rigvir-treated patients. In conclusion, Rigvir significantly prolongs survival in early-stage melanoma patients without any side effect.
- PMID:
- 26193376
- [PubMed - in process]
- PMCID:
- PMC4560272
-
References
1. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin 2014; 64:9–29. [PubMed]2. World Health Organization (WHO). Skin cancers. Available at: http://www.who.int/uv/faq/skincancer/en/index1.html. [Accessed 8 January 2015].3. World Health Organization. GLOBOCAN 2012: estimated cancer incidence, mortality and prevalence worldwide in 2012. Available at: http://globocan.iarc.fr/Pages/fact_sheets_population.aspx. [Accessed 10 January 2015].4. Marsden JR, Newton-Bishop JA, Burrows L, Cook M, Corrie PG, Cox NH, et al. Revised U.K. guidelines for the management of cutaneous melanoma 2010. Br J Dermatol 2010; 163:238–256. [PubMed]5. Tas F. Metastatic behavior in melanoma: timing, pattern, survival, and influencing factors. J Oncol 2012; 2012:647684. [PMC free article] [PubMed]6. Garbe C, Peris K, Hauschild A, Saiag P, Middleton M, Spatz A, et al. Diagnosis and treatment of melanoma. European consensus-based interdisciplinary guideline – update 2012. Eur J Cancer 2012; 48:2375–2390. [PubMed]7. Dummer R, Hauschild A, Guggenheim M, Keilholz U, Pentheroudakis G. Cutaneous melanoma: European Society for Medical Oncology (ESMO) Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (Suppl 7):86–91. [PubMed]8. National Comprehensive Cancer Network (NCCN). Clinical practice guidelines in oncology. Melanoma 2015; 2:1–69.9. National Cancer Institute (NCI). Melanoma. Treatment option overview. Available at: http://www.cancer.gov/cancertopics/pdq/treatment/melanoma/HealthProfessional/page1/AllPages#4. [Accessed 8 January 2015].10. Muceniece A. Oncotropism of viruses and the problem of virotherapy of malignant tumours (in Russian) Riga: Zinatne; 1972. 1–443.11. Ferdats A. Cancer virus hunting (in Latvian) Riga: Zinatne; 1977. 1–108.12. Mullen JT, Tanabe KK. Viral oncolysis. Oncologist 2002; 7:106–119. [PubMed]13. Kelly E, Russell SJ. History of oncolytic viruses: genesis to genetic engineering. Mol Ther 2007; 15:651–659. [PubMed]14. Liu TC, Galanis E, Kirn D. Clinical trial results with oncolytic virotherapy: a century of promise, a decade of progress. Nat Clin Pract Oncol 2007; 4:101–117. [PubMed]15. Bartlett DL, Liu Z, Sathaiah M, Ravindranathan R, Guo Z, He Y, Guo ZS. Oncolytic viruses as therapeutic cancer vaccines. Mol Cancer 2013; 12:103. [PMC free article] [PubMed]16. Lichty BD, Breitbach CJ, Stojdl DF, Bell JC. Going viral with cancer immunotherapy. Nat Rev Cancer 2014; 14:559–567. [PubMed]17. Muceniece A, Ferdats A. Cancer virotherapy. Virology (in Latvian) Riga: Zvaigzne; 1985. 187.18. Grigalinovich G, Rudzitis M, Skudra M, Popena B, Desjatnikova I, Garklava R. Effect of a viral immunomodulator (Rigvir®) on the morphology and survival of cutaneous melanoma patients (in Russian). Proc Latv Acad Sci 1988; 497:72–75.19. Heisele O, Glinkina L, Muceniece A, Garklava R. The effect of a viral immunomodulator, Rigvir, on the parameters of humoral immunity in malignant skin melanoma patients. Proc Latv Acad Sci 1991; 533:64–67.20. Glinkina LS, Heisele OG, Garklava RR, Muceniece AJ. The humoral immunity indices of patients with malignant skin melanoma using the viral immunomodulator Rigvir. Vopr Onkol 1992; 38:534–540. [PubMed]21. Glinkina LS, Bruvere RZ, Venskus DR, Garklava RR, Muceniece AJ. The cellular immunity indices of patients with malignant melanoma using the viral immunomodulator Rigvir. Vopr Onkol 1992; 38:540–547. [PubMed]22. Glinkina LS, Bruvere RZ. The reaction of the T-immunity system in patients with malignant skin melanoma and stomach cancer to active nonspecific immunotherapy. Vopr Onkol 1992; 38:659–666. [PubMed]23. Muceniece A. Rigvir – development of a viral immunomodulator and cancer virotherapy clinical trials (in Latvian) Riga: The 4th Latvian Congress of Physicians; 2001. 126–127.24. Bruvere R, Heisele O, Ferdats A, Rupais A, Muceniece A. Echovirus-mediated biotherapy for malignant tumours: 40 years of investigation. Acta Med Litu 2002; 9 (Suppl 9):97–100.25. Bruvere R, Feldmane G, Ferdats A, Heisele O, Muceniece A. Adjuvant immunotheraphy with virus-mediated biomodulators developed in Latvia: experimental and clinical data. Abstracts of the Perspectives in Melanoma X and The Third Annual International Melanoma Research Congress 14–16 September, Noordwijk, The Netherlands. Melanoma Res 2006; 16 (Suppl 1):S33–S34.26. Muceniece A, Venskus D. How to assess immunity – the melanoma model (in Latvian) Riga: Ainas Mucenieces society for cancer immunotherapy; 2007. 1–199.27. Chumakov PM, Morozova VV, Babkin, Baikov IK, Netesov SV, Tikunova NV. Oncolytic enteroviruses. Mol Biol (Mosk) 2012; 46:639–650.28. Garber K. China approves world’s first oncolytic virus therapy for cancer treatment. J Natl Cancer Inst 2006; 98:298–300. [PubMed]29. Frew SE, Sammut SM, Shore AF, Ramjist JK, Al-Bader S, Rezaie R, et al. Chinese health biotech and the billion-patient market. Nat Biotechnol 2008; 26:37–53. [PubMed]30. Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009; 27:6199–6206. [PMC free article] [PubMed]31. Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, Trotti A, editors. AJCC cancer staging manual, 7th ed New York, NY: Springer; 2010. 1–648.32. U.S. Department of Health and Human Services, National Institutes of Health, National Cancer Institute. Common terminology criteria for adverse events (CTCAE) V4. Bethesda, MD: National Institutes of Health; 2010. 1–79.33. Bourke MG, Salwa S, Harrington KJ, Kucharczyk MJ, Forde PF, de Kruijf M, et al. The emerging role of viruses in the treatment of solid tumours. Cancer Treat Rev 2011; 37:618–632. [PubMed]34. Russell SJ, Peng KW, Bell JC. Oncolytic virotherapy. Nat Biotechnol 2012; 30:658–670. [PMC free article] [PubMed]35. Vacchelli E, Eggermont A, Sautes-Fridman C, Galon J, Zitvogel L, Kroemer G, Galluzzi L. Trial watch: oncolytic viruses for cancer therapy. Oncoimmunology 2013; 2:e24612. [PMC free article] [PubMed]36. Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science 2013; 342:1432–1433. [PubMed]37. Kaufman HL, Andtbacka RHI, Collichio FA, Amatruda T, Senzer NN, Chesney J, et al. Primary overall survival (OS) from OPTiM, a randomized phase III trial of talimogene laherparepvec (T-VEC) versus subcutaneous (SC) granulocyte-macrophage colony-stimulating factor (GM-CSF) for the treatment (tx) of unresected stage IIIB/C and IV melanoma. J Clin Oncol 2014; 32:5s.38. Hauschild A, Gogas H, Tarhini A, Middleton MR, Testori A, Dreno B, Kirkwood JM. Practical guidelines for the management of interferon-alpha-2b side effects in patients receiving adjuvant treatment for melanoma: expert opinion. Cancer 2008; 112:982–994. [PubMed]39. Heisele O. The effect of a viral immunomodulator (Rigvir®) on the immune reactivity of patients with skin malignant melanoma (Riga). 1987; 1–166 (in Russian).40. Glinkina L. Effect of Rigvir® on systemic and local manifestations of immunity in patients with melanoma and gastric cancer (Riga). 1993; 1–171 (in Russian).41. Volrate A, Stefanovich HL. Sturis T, Muceniece A, Aleksandrova M, Černobajeva I, Volrate A, editors. Study of humoral immunity to enteroviruses in cancer patients (in Russian). Viral oncotropism (in Russian) Riga: Zinatne; 1969. 215–219.42. Henigst WW, Gelfand HM, Leblanc DR, Fox JP. ECHO virus type 7 infections in a continuously observed population group in Southern Louisiana. Am J Trop Med Hyg 1961; 10:759–766. [PubMed]43. Garklava R. Determination of oncotropism of enteroviruses in human tumours by adsorption (Riga). 1968; 1-246 (in Russian).44. Garklava R. Sturis T, Muceniece A, Aleksandrova M, Černobajeva I, Volrate A, editors. The adsorption of some enteroviruses in the tissues of gastric cancer and the human breast (in Russian). Viral oncotropism (in Russian) Riga: Zinatne; 1969. 41–52.45. Melcher A, Parato K, Rooney CM, Bell JC. Thunder and lightning: immunotherapy and oncolytic viruses collide. Mol Ther 2011; 19:1008–1016. [PMC free article] [PubMed]46. Hwang TH, Moon A, Burke J, Ribas A, Stephenson J, Breitbach CJ, et al. A mechanistic proof-of-concept clinical trial with JX-594, a targeted multi-mechanistic oncolytic poxvirus, in patients with metastatic melanoma. Mol Ther 2011; 19:1913–1922. [PMC free article] [PubMed]47. Grigalinovich G, Petrovska R. Morphological changes of human osteosarcoma cells in cell culture caused by a viral immunomodulator (Rigvir®) (in Russian). Proc Latv Acad Sci 1988; 497:69–71.48. Golubs G, Veinalde R, Petrovska R, Bruvere R, Pjanova D. Oncolytic activity of Rigvir® in various cell lines (Abstract). Riga, Latvia: 12th Joint symposium Riga-Rostock; 2014. 13–14.49. Garklava R, Bruvere R, Vitolina L, Priedite I, Muceniece A. Muceniece A, Augstkalne M, Volrate A, Bruvere R, Ferdats A, Heisele O, editors. Morphological and clinical parallels of changing rectal cancer during combined treatment. Immunological aspects of viral oncotropism (in Russian) Riga: Zinatne; 1979. 114–120.50. Bruvere R, Vitolina L, Garklava R, Priedite I, Muceniece A. Influence of a viral immunomodulator (Rigvir®) on cellular composition and topographic characteristics of the infiltration of the stroma of primary tumours of colorectal cancer (in Russian). Proc Latv Acad Sci 1980; 396:137–142
Gerelateerde artikelen
- Poeptransplantatie - Fecale Microbiota Transplantatie (FMT) vergroot effectiviteit van immuuntherapie bij niet-kleincellige longkanker en melanomen copy 1
- TIL - Tumorinfiltrerende Lymfocyten therapie met Amtagvi - lifileucel geeft alsnog uitstekende resultaten bij patienten met gevorderde zwaar voorbehandelde melanomen waar eerder immuuntherapie met anti-PD medicijnen faalde
- mRNA-4157 (V940) in combinatie met pembrolizumab geeft veel langere recidiefvrije overleving en minder uitzaaiingen op afstand bij patiënten met hoogrisico stadium III/IV melanoom na operatie in vergelijking met alleen pembrolizumab
- RP1, een gemodificeerd herpes virus, geeft in combinatie met nivolumab alsnog uitstekende resultaten bij patienten met uitgezaaide melanoom waar eerder anti-PD immuuntherapie faalde
- Immuuntherapie met pembrolizumab of ipilimumab voor patienten met melanomen stadium IV en III inoperabel geeft overall overleving van 45 procent op 10 jaars meting, aldus de resultaten uit de Keynote 006 studie
- Immuuntherapie vooraf aan operatie geeft sterk verbeterde resultaten op overall overleving en minder recidieven bij patienten met een melanoom
- Uitgezaaide oogmelanoom bevat soms immuuncelkenmerken die patienten gevoelig kan maken voor TIL therapie (adoptieve tumor-infiltrerende lymfocyten - TIL)
- Mediterraan dieet stimuleert effectiviteit van immuuntherapie met anti-PD medicijnen - checkpointremmers voor patiënten met een melanoom in een gevorderd stadium copy 1
- Tumor-infiltrerende lymfocyten therapie (TIL) verbetert progressievrije overleving en mediane overall overleving bij patiënten met gevorderd melanoom (Stadium IIIc - IV) in vergelijking met standaard immunotherapie met ipilimumab.
- Vrouw met een progressief stadium IIIB-melanoom behandeld met oncolytisch ECHO-7-virus = RIGVIR virus komt in totale remissie en is nu al 10 jaar klinisch kankervrij na 1e diagnose
- Pembrolizumab gegeven na operatie voor melanoompatienten met stadium IIB en IIC verminderde het risico op overlijden en recidief met 35 procent in vergelijking met een placebo
- Relatlimab plus nivolumab geeft in vergelijking met alleen nivolumab langere ziektevrije tijd bij eerstelijns gevorderde melanoom
- Nivolumab plus ipilimumab geeft betere mediane overall overleving (72 maanden vs 37 maanden) dan alleen nivolumab of alleen ipilimumab bij patienten met inoperabele melanomen.
- Pembrolizumab geeft betere ziektevrije tijd en minder bijwerkingen in vergelijking met hoge dosis interferon (HDI) of ipilimumab bij patiënten met een geopereerd melanoom met een hoog risico op een recidief
- Chronische immuungerelateerde bijwerkingen komen veelvuldig voor bij patiënten met stadium III-IV melanoom die worden behandeld met immuuntherapie met anti-PD medicijnen
- Fecale microbiota transplantatie - FMT overwint resistentie tegen anti-PD-1-therapie bij melanoompatiënten en zorgt alsnog voor aanslaan van immuuntherapie met anti-PD medicijnen
- Immuuntherapie met nivolumab plus ipilimumab geeft veel betere overall ziektevrije overleving (plus 28 en 38 procent) in vergelijking met alleen nivolumab of placebo bij patiënten met operabele stadium IV melanoom zonder bewijs van ziekte na operatie
- Melanoompatiënten (stadium IV) die na een gerichte behandeling toch ziekteprogressie tonen, hebben baat bij daarna immuuntherapie met anti-PD-1 medicijnen en gelijke overall overleving als bij eerstelijns met anti-PD-1 medicijnen.
- Er is een sterk positief verband met het aantal immuun-gerelateerde bijwerkingen (irAE's) en recidiefvrije overleving bij melanoompatiënten met een hoog risico in stadium III die werden behandeld met pembrolizumab.
- Immuuntherapie met T-VEC = talimogene laherparepvec voor huidkanker waaronder melanomen wordt ook in Nederland toegepast in studieverband. Bv. In UMCG Groningen
- Melanoom tumoren met V600K BRAF mutatie reageren minder goed op gerichte behandelingen dan met V600E mutaties, maar V600K BRAF geeft betere resultaten op immuuntherapie met anti-PD medicijnen copy 1
- Biomarkers zoals PD-L1, CD163+ en NRAS mutaties en gegevens zoals uitzaaiingen later ontstaan bepalen kans van effectiviteit van immuuntherapie met anti PD medicijnen bij melanomen copy 1
- Immuuntherapie met pembrolizumab voorkomt veel beter recidief (met 43 procent) van operabele melanoom stadium III in vergelijking met placebo ook zonder PD-1 mutatie
- Bepaalde darmbacteriën kunnen de effectiviteit van immunotherapie met anti-PD medicijnen verhogen bij de behandeling van melanomen copy 1
- Pembrolizumab superieur in ziektevrije tijd, overall overleving en met significant minder bijwerkingen dan Ipilimumab bij inoperabele gevorderde melanomen.
- Immuuntherapie met een gepersonaliseerd vaccin geeft uitstekende resultaten bij operabele melanoompatienten, meer dan de helft bereikte een duurzame complete remissie copy 1
- Immuuntherapie met gemoduleerd herpes virus succesvol bij melanoompatienten in Anthonie van Leeuwenhoek ziekenhuis.
- Biomarkers - DNA mutaties en receptorenexpressie - zijn bepalend voor succes van immuuntherapie bij melanomen al lijkt algemene dendritische celtherapie als immuuntherapie ook zinvol
- Nivolumab als enige behandeling geeft 34 procent 5 jaars overleving bij zwaar voorbehandelde melanoompatienten
- Immuuntherapie met het RIGVIR virus bij operabele melanomen met stadia IA t/m IIC geeft 35 procent meer overlevingen op 3 tot 5 jaar in vergelijking met standaard behandeling copy 1
- Immuuntherapie met TIL - tumor infiltrating lymfocyten zorgt bij een kwart van de deelnemers voor jarenlange ziektevrije tijd bij patienten met uitgezaaide melanomen copy 1
- Dendritische celtherapie gecombineerd met hyperthermie verdubbelt overleving (van 6 tot 13 maanden) van patienten met vergevorderde melanomen.
- Vaccinatie samen met interleukon-2 (IL-2) verlengt significant ziektevrije tijd van melanoompatienten in vergelijkiing met alleen interleukon 2.
- Immunotherapie - na chemo lijkt succesvol bij melanomen graad IV.
- Immuuntherapie Onderzoekers aan de universiteit van Virginia melden positieve resultaten uit een kleinschalige (26 deelnemers) gerandomiseerde phase II studie naar de effecten van een vaccin met multi-peptides
- Nederlandse ziekenhuizen die ipilimumab (Yervoy) of vemurafenib (Zelboraf) mogen voorschrijven voor uitgezaaide melanoom
- Immuuntherapie met Interferon Alpha 2B bij patienten met melanomen geeft ten opzichte van een wait and see beleid op een meetpunt van 3,8 jaar een significant verschil in mediane ziektevrije overlevingstijd van 18%. Aldus gerandomiseerde fase III studie
- Immuuntherapie: autovaccinatie (van eigen kankercellen wordt een vaccin gemaakt) bij melanoompatienten zorgt bij 50 procent van deelnemende patienten voor langjarige remissies. Vooral melanoompatienten met MELOE-1 lijken gevoelig voor deze aanpak
- Immuuntherapie: patient met vergevorderde melanoomkanker geneest doordat gekloonde cellen van eigen afweercellen als vaccin zijn teruggebracht in zjin lichaam.
- Monoclonaal middel werkt uitstekend als vaccinatie en immuunstimulerend middel bij muizen met melanoomkanker.
- Immuuntherapie en melanomen: Antibody therapie kan het positieve effect van een vaccin vergroten blijkt uit kleinschalige studie met 9 uitbehandelde eierstokkankerpatiënten en melanoompatiënten.
- Immuuntherapie bij melanomen: een overzicht van recente ontwikkelingen en belangrijke studies



Plaats een reactie ...
Reageer op "Immuuntherapie met het RIGVIR virus bij operabele melanomen met stadia IA t/m IIC geeft 35 procent meer overlevingen op 3 tot 5 jaar in vergelijking met standaard behandeling copy 1"