Helpt u ons aan 500 donateurs?
28 mei 2018: Bron: RIVM
Het RIVM heeft een rapport opgemaakt over het gebrijk van bateriofagen bij infecties na bezoek aan het Georgische George Eliava Instituut waar al heel lang gewerkt wordt met bacteriofagen. (zie verderop in dit artikel)
Het RIVM schrijft in hun rapport dat er is te weinig kennis is over hoe bacteriofagen werken in het menselijk lichaam om ze nu al bij infecties te kunnen gaan gebruiken. Naast meer onderzoek zou ook aangepaste wet- en regelgeving nodig zijn om deze virussen in te kunnen zetten bij infecties in mensen. Tot die conclusie komt het Rijksinstituut voor Volksgezondheid en Milieu (RIVM), dat de huidige kennis over en ervaring met bacteriofagen in een rapport op een rijtje heeft gezet.
Het rapport: Bacteriofagen. Huidige kennis, onderzoek en toepassingen’ is gratis in te zien op de website van het RIVM.
Publiekssamenvatting
Bacteriofagen (ofwel fagen) zijn virussen die bacteriën kunnen doden. Ze werden begin vorige eeuw ontdekt, ongeveer tegelijk met antibiotica. Fagen hebben een ander werkingsmechanisme dan antibiotica. In theorie zouden ze daarom kunnen worden ingezet om infecties te behandelen die ongevoelig zijn voor antibiotica. Er is echter nog te weinig onderbouwd klinisch onderzoek beschikbaar om de meerwaarde van bacteriofaagbehandeling te kennen en dit veilig en voor meerdere soorten infecties te kunnen doen. Dit blijkt uit een inventarisatie die het RIVM heeft gemaakt van de huidige kennis over bacteriofagen voor de behandeling van infecties bij mensen.
Een faag werkt heel specifiek tegen één type bacterie, terwijl antibiotica werkzaam zijn tegen meerdere bacteriesoorten. Hierdoor kunnen fagen niet zo snel worden ingezet tegen infecties: eerst moet de ziekmakende bacterie geïdentificeerd en opgekweekt worden, waarna er een bijpassende faag of fagen bij moeten worden gezocht. Om deze praktische redenen hadden antibiotica meer succes en is het gebruik van fagen op de achtergrond geraakt.
De kennis over de precieze werking van bacteriofagen bij behandeling van infecties, hoe ze zich gedragen in het lichaam, welke dosering en behandelduur nodig zijn, en de risico's van gebruik is nog beperkt. Door het tijdrovende en complexe bereidingsproces zijn bacteriofagen niet geschikt om acute infecties te behandelen. In theorie zouden ze wel bij chronische infecties kunnen werken, bijvoorbeeld voor oppervlakkige huidinfecties. Om vragen over zulke toepassingen en de meerwaarde daarvan te beantwoorden is gecontroleerd klinisch onderzoek noodzakelijk, maar dat ontbreekt nog.
Daar komt bij dat de huidige Europese wet- en regelgeving voor geneesmiddelen niet gemaakt is voor patiëntspecifieke biologische producten, zoals bacteriofagen. In Europees verband wordt erover nagedacht om de wet- en regelgeving voor biologische producten te veranderen. In andere sectoren, zoals landbouw en voedselproductie, gelden minder strenge regels voor werkzaamheid en het gebruik van deze producten dan voor gebruik bij mensen. In deze sectoren worden fagen al wel ingezet.
24 oktober 2017: Bron o.a. DWDD en Wikipedia
Afgelopen vrijdag 20 oktober 2017 vertelde Antoinette Hertsenberg in DWDD (zie hier de uitzending van DWDD) over de aanpak met een bacteriofaag, virussen die bacteriën van binnenuit doden, voor resistente bacteriën waar antibiotica niet meer werkt. Met een sprekend voorbeeld van iemand die door de bacteriofaag zijn benen zou verliezen (diabeteswonden), maar door de bacteriofaag aanpak de bacterie in zijn been volledig wegkreeg en daarmee zijn been behield. Het verhaal werd zoals we wel kennen van Antoinette Hertsenberg uit haar RADAR uitzendingen met veel drama en overdrijving, maar was natuurlijk in eerste instantie bedoeld om aandacht te vragen voor de uitzending van Dokters van Morgen te zien op dinsdag 24 oktober 2017 21.30 uur NPO 1.
Ook de gespeelde verbazing en onwetendheid van Matthijs van Nieuwwkerk klonk echt ongeloofwaardig. Ik neem toch aan dat bij het aanbod van Antoinette Hertsberg om haar verhaal te doen de redactie op z'n minst even heeft gezocht via google. Dan hadden zij heel veel informatie gevonden. Want er was al eerder een uitzending over dit onderwerp, zie Bacteriofagen: een alternatief voor antibiotica? d.d. 21 maart 2017 op NPO 1.
Of bekijk: Eerste Nederlander gered met bacteriofaag hoewel de man Bart Vissers later alsnog toch is overleden aan een hartstilstand: Volgens de programmamakers van het AVROTROS-programma Zorg.nu staat het overlijden van Bart Vissers (61) los van de therapie die hij ondergaan heeft. "Vissers leed aan meerdere complicaties en is uiteindelijk overleden aan een hartstilstand", aldus zijn behandelend arts.(tekst gaat verder onder plaatje van bacteriofaag)
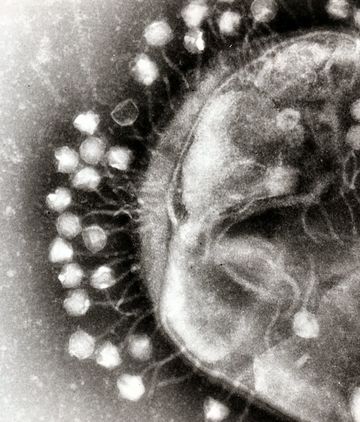 Een bacteriofaag
Een bacteriofaag
En ook in België en Nederland worden bacteriofagen dus ontwikkeld. In belgië in samenwerking met het door Antionette Hertsenberg genoemde Eliava instituut in Georgië. Dit Instituut is al sinds de jaren twintig van de vorige eeuw met deze techniek bezig. Het instituut in Tblisi is in 1923 opgericht. Het is daar heel normaal om voor een fagenbehandeling te kiezen. De wachtkamer zit vol met Georgiërs met de meest uiteenlopende kwalen. Maar sinds een paar jaar komen er ook vanuit Amerika, Frankrijk, India, Zwitserland en zelfs uit Uruguay patiënten die als laatste redmiddel voor een fagentherapie kiezen. Zij komen uit landen waar antibioticagebruik buitensporig is en resistentie daardoor ook.
In het militair hospitaal Koningin Astrid in Brussel is dr. Jean Paul Pirnay hoofd van het fagenlab. Hij produceert fagen voor mensen die aan het eind van hun latijn zijn. Antibiotica werken niet meer voor deze patiënten. Hij gebruikt hierbij de verklaring van Helsinki (artikel 37) die het toestaat met goedkeuring van de patiënt een experimenteel medicijn toe te dienen wanneer niets anders meer helpt. Zo produceerde hij ook fagen voor Bart Vissers die door doorligwonden de gevaarlijke Pseudomonas bacterie opliep. Hij kon geen antibioticakuur meer verdragen en dreigde te sterven. Hij had al maanden kuren achter de rug. Dr. Serge Jennes, hoofd Brandwondencentrum diende hem als laatste redmiddel een fagenkuur toe. De Pseudomonasbacterie verdween. De Belgische minister van Volksgezondheid heeft onlangs toestemming gegeven om apotheken in België ook fagen te laten verstrekken. Dr. Pirnay kan ze in zijn lab ontwikkelen, in eerste instantie voor 'hopeloze gevallen' en voor gecontroleerde studies. Als deze applicaties succesvol zijn, dan hoopt Pirnay dat de industrie deze fagen op grotere schaal zal produceren.
(Tekst gaat verder onder plaatje dat het werkingsmechaniosme van de bacetriofasgen weergeeft)
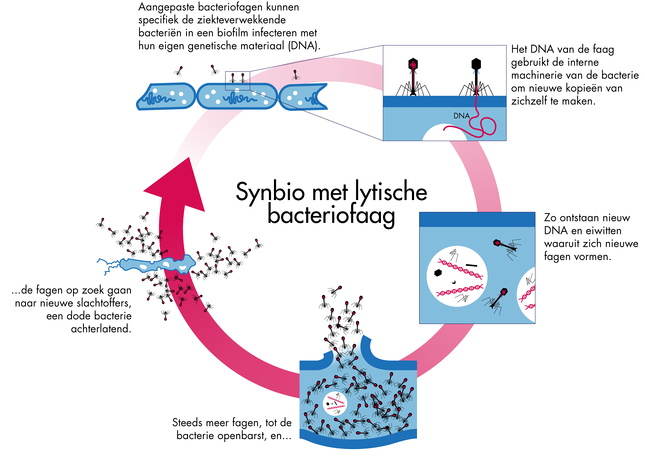
Bron foto boven: Kennislink
Het goede van de publiciteit is dat het werkingsmechanisme interessant is en wellicht ook gebruikt kan worden bij kankerpatienten die in bestraald gebied een bacterie hebben gekregen en die amper zijn te behandelen. Denk maar aan borstkankerpatiënten die nu via hyperbare zuurstoftherapie soms proberen de problemen in bestraald gebied op te lossen. (ik heb zelf ook 40 dagen hyperbare zuurstoftherapie gehad en op sommige dagen waren er ook borstkankerpatienten met infecties in bestraald gebied.) Al is in dit geval niet altijd sprake van een resistente bacterie denk ik. Maar weet dat niet zeker. Misschien is een bacterie wel altijd de oorzaak. Bij mij werd het preventief voorgeschreven om infecties te voorkomen bij het operatief verwijderen van mijn kiezen, liggend in bestraald gebied.)
Informatie over bacteriofagen zijn al jaren te vinden op internet. Dit artikel: Virussen: een goed alternatief voor anti-biotica? in Kennisnet geeft duidelijke en heldere informatie over de ontwikkeling van bacteriofagen.
 Bacteriofaag uit Wikipedia
Bacteriofaag uit Wikipedia
En ook op wikepedia is veel informatie over bacteriofagen te vinden.
En uiteraard is al onderzoek gedaan naar bacteriofagen therapie. Dit volledige studierapport van een reviewstudie uit 2014 geeft interessante informatie: Viruses versus bacteria—novel approaches to phage therapy as a tool against multidrug-resistant pathogens gepubliceerd in het tijdschrift met de veelzeggende titel: Journal of antimicrobial chemotherapy. Abstract staat hieronder met referentielijst.
Hun conclusie:
As a final remark, patients suffering from multidrug-resistant pathogenic infections should soon be allowed access to phage therapy to ultimately achieve an ‘ESKAPE’ from the threat of untreatable bacterial infections.
Samenvattend wellicht de moeite waard naar de uitzending van Dokters van Morgen te kijken op dinsdag 24 oktober 2017 21.30 uur NPO 1, maar de aanpak daarmee is niet in alle gevallen succesvol. Al blijft het een interessante ontwikkeling.
This review presents novel strategies for phage-related therapies and describes our current knowledge of natural bacteriophages within the human microbiome.
Bacteriophage therapy (the application of phages to treat bacterial infections) has a tradition dating back almost a century, but interest in phage therapy slowed down in the West when antibiotics were discovered. With the emerging threat of infections caused by multidrug-resistant bacteria and scarce prospects of newly introduced antibiotics in the future, phages are currently being reconsidered as alternative therapeutics. Conventional phage therapy uses lytic bacteriophages for treatment and recent human clinical trials have revealed encouraging results. In addition, several other modern approaches to phages as therapeutics have been made in vitro and in animal models. Dual therapy with phages and antibiotics has resulted in significant reductions in the number of bacterial pathogens. Bioengineered phages have overcome many of the problems of conventional phage therapy, enabled targeted drug delivery or reversed the resistance of drug-resistant bacteria. The use of enzymes derived from phages, such as endolysin, as therapeutic agents has been efficient in the elimination of Gram-positive pathogens. This review presents novel strategies for phage-related therapies and describes our current knowledge of natural bacteriophages within the human microbiome. Our aim is to provide an overview of the high number of different methodological concepts, thereby encouraging further research on this topic, with the ultimate goal of using phages as therapeutic or preventative medicines in daily clinical practice.
As a final remark, patients suffering from multidrug-resistant pathogenic infections should soon be allowed access to phage therapy to ultimately achieve an ‘ESKAPE’ from the threat of untreatable bacterial infections.
References
Gerelateerde artikelen
- Archief nieuwsberichten over kanker in de media
- Drie dure maar bewezen effectieve medicijnen Carvykti Ciltacabtagene Autoleucel, Enhertu Trastuzumab Deruxtecan en Xenpozyme Olipudase alfa worden niet vergoed uit het basispakket omdat ze te duur zijn
- Dertien veel voorkomende zorghandelingen in het ziekenhuis verdwijnen binnenkort uit de richtlijnen omdat de effectiviteit niet bewezen is.
- Wim Hof die wereldberoemd werd als 'de iceman' blijkt jarenlang zijn gezin geterroriseerd te hebben en wordt beschuldigd door ex-vrouw en kinderen van huiselijk geweld
- Parpremmers olaparib (Lynparza®) of niraparib (Zejula®) voor eierstokkanker en borstkanker worden gedeeltelijk uit basisverzekering gehaald door Zorginstituut Nederland
- Wetenschap is gebaseerd op een mening en te weinig kritisch, aldus Dick Veerman en collega's n.a.v. 30 diepte interviews met hoogleraren, universitaire hoofddocenten, postdocs, assistenten in opleiding (PhD’ers) en wetenschappelijke onderzoekers
- Dure medicijnen zijn oorzaak van stijgende zorgkosten. En betere opsporingstechnieken zorgt voor meer kankerdiagnoses blijkt uit onderzoek van IKNL en RIVM
- 34 procent van alle kankerpatienten stierf tussen 2010 en 2020 voor het 5e jaar na de diagnose. Toch spreekt Integraal Kankercentrum Nederland (IKNL) van een verbetering
- Kankerpatiënten met een laag inkomen hebben in Nederland een grotere kans om aan de ziekte te overlijden dan welvarende patiënten. Blijkt uit nieuw onderzoek van het Integraal Kankercentrum Nederland
- Nederlandse filmpremière “First Do No Pharm” van dr. Asheem Malhotra in Zeist op 21 november 2024
- Retour Hemel: documentaire over strijd tegen kanker van Mark Bos die zelf prostaatkanker heeft.
- Kankerpil - AOH1996, van professor Linda Malkas die alle solide tumoren zou vernietigen is aan eerste patient gegeven in fase I studie
- Patienten met zeldzame vormen van kanker overlijden vaker en krijgen latere diagnose in vergelijking met veel voorkomende vormen van kanker door het niet kunnen vinden van gespecialiseerde behandelcentra
- Sterkere MRI-scanner met nieuw contrastmiddel ontdekt uitzaaiingen van prostaatkanker in lymfklieren tot op 1 mm nauwkeurig blijkt uit Nederlandse studie aan Radboud universiteit.
- Er dreigt een wereldwijde kankerepidemie onder mensen jonger dan 50 jaar, vooral aantal darmkankerpatienten stijgt enorm blijkt uit nieuwe studie. Is er verband met corona vaccins?
- Nederlands vaccin gebruikt als immuuntherapie geneest hond van botkanker - osteacarcinoom en honden met blaaskanker reageren ook goed op het vaccin dat zich richt op het eiwit vimentine
- Je hebt kanker en hoe ga je daarmee om? Ben je streng voor jezelf, hoe ga je om met anderen die het moeilijk hebben? Kennislink interviewde 26 mensen met kanker.
- Bij meer dan 100 leerlingen van 1 school blijkt later in hun leven een zeldzame vorm van een hersentumor voor te komen. Oorzaak is nog onduidelijk.
- Frankrijk gaat groot onderzoek doen naar ontstaan en voorkomen of behandelen van endometriose met een nationaal plan van aanpak.
- Salmonella-bacterie met succes gebruikt bij muizen tegen moeilijk behandelbare kankers. Blijkt uit onderzoek aan universiteit van Leuven
- Prof. dr Michel Wouters wil met behulp van ‘real world data’ oncologische behandelprocessen verbeteren en studieresultaten toetsen aan de dagelijkse praktijk
- Tientallen ziekenhuizen schrappen dringende operaties vanwege coronadruk. Ook operaties voor kankerpatienten en stamceltransplantaties.
- Patiëntenfederatie Nederland, wordt voor meer dan 80 procent gefinancierd door het ministerie van Volksgezondheid en zorgverzekeraars en roept grote vraagtekens op over hun onafhankelijkheid.
- Veel meer longkanker in de omgeving van Tatasteel. In sommige wijken komt meer dan 50 procent meer longkanker voor in vergelijking met landelijke gemiddelde.
- UMCG Groningen gaat zelf Car-T cellen maken om zo immuuntherapie met CAR-T cellen sneller en goedkoper te geven aan kankerpatienten.
- Een nieuw ontwikkelde methode om longkankeroperaties te doen met behulp van een virtualrealitybril blijkt zeer succesvol. Aldus chirurgen uit Erasmus Medisch Centrum
- Vrouw die borstkanker overleefde maar onvruchtbaar was geworden door de chemotherapie krijgt toch baby door ingevroren eitje met sperma in te spuiten en IVF toe te passen.
- Te veel mensen, te weinig vis, dus een omega-3 (visolie) tekort. Aldus Noorse studie en gepubliceerd in Nature
- Wetenschappers ontdekken manier van immuuntherapie met T-cellen gericht op het eiwit MR1 die voor alle vormen van kanker toepasbaar zou kunnen worden.
- Diabetoloog dr. Hanno Pijl ziet de ene arts na de andere omvallen en pleit voor Nationaal gezondheidsplan om welvaartsziekten als diabetes en ook kanker te stoppen
- CAR-T celtherapie is zeer succesvol bij kankerpatienten maar loopt in Nederland vast op te strenge milieueisen, stellen 4 Nederlandse top wetenschappers
- Robert Young is een bekende Amerikaanse natuurgenezer en schreef verschillende boeken over niet toxische middelen en dieet maar kwam in de gevangenis terecht. Hier zijn verweer op video voor de Amerikaanse Commissie
- Wereldgezondheidsorganisatie (WHO) neemt traditionele Chinese geneeskunde - TCM waaronder acupunctuur op in de International Statistical Classification of Diseases and Related Health Problems (ICD).
- 300 reeds geregistreerde medicijnen voor andere ziektes - Repurposing Drugs in Oncology (ReDO) - hebben ook effect bij kanker blijkt uit onderzoek van het AntiCancer Fund
- Hoogleraar Sjaak Neefjes brengt oud kankermedicijn terug op de markt. Bekijk hier dit onderwerp in de uitzending van DWDD met Sjaak Neefjes
- Ziekenhuizen houden zich niet aan de regels voor opereren van kankerpatienten in daarvoor gespecialiseerd ziekenhuis. Honderden kankerpatienten lopen onnodig extra risico
- Nobelprijs voor Geneeskunde voor onderzoek naar cellen en zuurstof
- hormoontherapie tegen overgangsklachten geeft een hoger risico op kanker dan werd gedacht. Blijkt uit grote meta-analyse van 58 epidemologische studies
- Het is misschien toch fijner te weten dat je dood gaat. Danielle Hermans dacht ze dood ging aan longkanker maar blijft toch leven en vertelt hoe ze daar mee omgaat
- Gezonde voeding lijkt sleutel voor het indammen van chronische ziekten, zo schrijft internist Yvo Sijpkens,
- The Promise and Price of Cellular Therapies door Siddhartha Mukherjee: van stamceltransplantatie naar CAR-T celtherapie
- Relatief weinig mensen maken gebruik van medische zorg in het buitenland, ondanks dat dit ook vergoed wordt, zo meldt de Europese Rekenkamer na Europees onderzoek
- Crowdfunding voor medische doeleinden is populair maar zelden succesvol en artsen en oncologen maken zich zorgen
- Hoe betrouwbaar is de wetenschap eigenlijk? Rosanne Herzberger is daarover kritisch en Job de Vrieze bekijkt het van zijn kant in een column op Foodlog
- Red onze kinderen: stop de tabaksindustrie! Doe mee en ondersteun Anne Marie die door roken kanker kreeg en haar kinderen en alle andere kinderen daartegen wil beschermen.
- Je geld of mijn leven van de EO (Bert van Leeuwen) probeert geld op te halen voor patienten die alleen in het buitenland nog behandeld kunnen worden.
- Documentaire De zaak Tuitjenhorn over huisarts Nico Tromp en zijn vrouw Anneke en hun kinderen in conflict met Inspectie voor de Gezondheidszorg is maandag 6 mei te zien op NPO 2 om 20.25 uur.
- Tisotumab vedotin plus chemo geeft spectaculaire resultaten bij zwaarvoorbehandelde kankerpatienten met verschillende primaire vormen van kanker met solide tumoren. copy 1
- Immuuntherapie met aminozuren, MuTaTu protocol, zal binnen paar jaar alle kanker kunnen genezen schrijven Israelische onderzoekers
- De wetenschap achter de verbanning van vetzucht, alcohol en roken. Een artikel in de NRC over het preventieakkoord van Staatssecretaris Paul Blokhuis
- Hoe pembrolizumab, een nederlands immuuntherapeutisch medicijn tegen kanker, de wereld verovert
- Interview met longarts Ben van den Borne over succes van immuuntherapie bij niet-kleincellige longkanker
- Peperdure pillen, VPRO Tegenlicht volgt vijf professionals die dit niet meer accepteren en vanuit hun persoonlijke betrokkenheid in actie komen en met nieuwe modellen experimenteren. Uitzending is. zondag 7 oktober 2018 NPO 2 om 21.05 uur.]
- Anders kijken naar kanker is een serie gemaakt door Sophia van Sorgen, ex-kankerpatiente en te zien bij het Algemeen Dagblad
- Hartfalen lijkt ook verhoogd risico op darmkanker te geven. Bepaalde biomarkers (factoren) blijken voor hartfalen en darmkanker dezelfde te zijn.
- Nederlandse oncologie zit vastgeklemd in protocollen en statistieken blijkt uit studie bij kankerpatienten die voor second opinion naar buitenland gingen
- Deze 11 studies worden mogelijk gemaakt met het geld dat Maarten van der Weijden ophaalde met zijn 11 steden zwemtocht.
- Skepsis bijna blut door rechtszaak over artikel waarin zij de Italiaanse Amerikaan Ruggero Santilli beschuldigen van kwakzalverij en bedrog
- Is bacteriofaag de oplossing voor resistente bacterien waar antibiotica faalt? Antoinette Hertsenberg prijst deze aanpak aan in DWDD die al veel langer bekend is.
- Ashya King, kind met een hersentumor (medulloblastoma) is al ruim 3 jaar kankervrij door suikervrij dieet en protonenbestraling ondanks hopeloze situatie in 2014
- Voeding - Red-dieet zorgt binnen 5 weken ervoor dat 6 van de 10 kinderen van hun ADHD afkomen en geen medicijnen meer nodig hebben. BRAIN-studie zoekt nog kinderen voor deelname aan studie
- Openbaar Ministerie (OM) gaat tabaksindustrie niet vervolgen. Aanklagers - sickofsmoking - zeggen artikel 12 procedure te starten.
- Zorginstituut eist inzage in opbouw kosten van nieuwe dure medicijnen voor deze worden opgenomen in basisverzekering.
- Molucuul dat ziekte van Huntington veroorzaakt op lange termijn doodt kanker op korte termijn zonder gezonde cellen aan te tasten blijkt uit dierstudies.
- NRC publiceert twee artikelen over Wim Huppes die als arts is geschorst maar als alternatieve genezer patienten blijft behandelen met dubieuze lichttherapie
- Twee VU-hoogleraren hopen op doorbraak in de zoektocht naar een dieet dat helpt tegen depressie, adhd of autisme, aldus artikel in de Volkskrant
- Alles draait om de patient die niets te zeggen heeft. Schrijft Peter Kapitein in het Parool
- Suiker doet tumoren groeien en maakt kanker agressiever en bewijst Warburg effect. Een suikerarm dieet voor kankerpatienten is aan te bevelen aldus prof. dr. Johan M. Thevelein na zijn baanbrekende onderzoek
- Veel Nederlands voedsel (47 procent) waaronder alledaagse voedingsmiddelen zoals cornflakes, pasta en hagelslag is besmet met minerale oliën - MOAH en kunnen kanker veroorzaken.
- Prostaatkankerpatienten weten vaak niet wat het verschil is tussen behandelingsopties voor hun eigen situatie met niet uitgezaaide prostaatkanker. En realiseren zich onvoldoende wat de verschillende bijwerkingen per behandelingsoptie zijn
- Inspire2live lokt proefproces uit voor betaalbare medicijnen. Recht op gezondheid of patentrecht: wat gaat voor?
- Immuuntherapie met DNA injectie van bacterien look-a-like (CpG-B) bij beginnende melanomen geeft uitstekende resultaten in voorkomen van recidief door boost in activering van immuunsysteem
- Geen chemo of bestraling, maar zwemmen in koud water. NRC interviewde mensen die kiezen voor niet toxische aanpak, door NRC alternatieve geneeswijzen genoemd
- Alleen alternatieve behandelingen van kanker zouden risico op overlijden aan kanker hoger maken dan reguliere behandelingen.
- Nederlandse kankerpatienten overlijden na behandelingen in prive kliniek van Klaus Ross in Bracht Duitsland.
- Lymfoedeem is op te lossen met lymfkliertransplantatie, lees verhaal van ex borstkankerpatient Mirjam Bosgraaf in de Volkskrant
- Astroturf en hoe Big Pharma via de media en sociale media patienten en artsen misleidt en manipuleert. Zie de TEDtalk van Sheryll Attkisson
- KWF en NFK hebben ruzie over patienten website kanker.nl. Kankerpatienten lijken de dupe te worden van machtstrijd aldus de Volkskrant
- Thuis immuuntherapie krijgen. Anthonie van Leeuwenhoek ziekenhuis start proef met immuuntherapie voor longkankerpatienten
- Veel farmaceutische bedrijven misbruiken kankerpatienten in arme landen voor hun wetenschappelijk onderzoek, aldus kritisch rapport van de SOMO.
- Being Mum and Dad, een BBC documentaire van Rio Ferdinand, voetballer van Manchester United die zijn vrouw Rebecca verloor aan borstkanker
- Medicijnen tegen kanker innemen met ontbijt zou effectiviteit verbeteren en mindere dosering zou miljoenen kunnen besparen
- Dure medicijnen moeten goedkoper door deze zelf te maken aldus Rene Bernards en Jan Schellens in de DWDD van 8 februari 2017
- Immuuntherapie 2.0: ASCO komt met overzichtsrapport van de nieuwste ontwikkelingen bij kanker van afgelopen jaar en voorspellingen voor 2017
- Hersentumoren van type glioblastoma multiforme komt in Engeland steeds vaker voor terwijl laaggradige vormen van hersentumoren verder dalen. Is de oorzaak mobiele telefoons?
- Protonenbestraling komt beschikbaar in Delft en gaat vanaf eind 2017 volledig vergoed worden
- RIVM geeft via hun folder onjuiste en misleidende informatie over darmkankeronderzoek onder de Nederlandse bevolking.
- Bekijk aflevering van Zorg.nu over immuuntherapie met dr. Haanen en prof. dr. Schumacher d.d. 1 novermber 2016
- RTL late night uitzending met Hester Scheffer met informatie over de nanoknife - IRE - irreversible electroporation
- Farmaceutische bedrijven sponsoren en betalen artsen veel meer geld dan eerdere jaren. Onafhankelijkheid van artsen en patientenverenigingen staan op het spel
- 3-broompyruvaat, stofje waaraan patienten in kliniek van Klaus Ross overleden blijkt soms ook genezende behandeling voor uitgezaaide kanker en heeft enorme potentie
- Nederland staat tweede op wereldranglijst van aantal slokdarmkankerpatienten. Alcohol, roken, reflux - maagzuur en obesitas zijn grootste oorzaken van slokdarmkanker
- Sommige artsen helpen kankerpatienten aan nieuwe dure medicijnen door een deal met een farmaceutisch bedrijf
- De duizend-dollarpil of hoe een farmaceut de hoofdprijs vraagt voor Sovaldi een genezend medicijn voor hepatitis-C
- Urinetest en voorgeprogrammeerde probiotica kunnen kankercellen in heel vroeg stadium opsporen volgens prof. dr. Sangeeta Bhatia
- Het Farma Fortuin: Zembla woensdag 9 maart 2016. NPO 2 21.15. Over waarom medicijnen zo duur zijn en wie er allemaal aan verdienen
- Eerlijke Geneesmiddelen Voorziening (EGV) en advocatenkantoor Kienlegal spelen zeer dubieuze rol door belangenverstrengeling in vaststellen van prijzen van nieuwe dure medicijnen
- Kankermedicijnen kunnen nu getest worden op gekweekte darmtumoren, om te zien welke het beste aanslaat. Zie Hans Clevers met mooie uitleg in DWDD van 8 mei 2015
- Symposium op 21 maart 2016 over andere manier van studies opzetten met hulp van patienten voor voeding en ziektes: Beyond RCT’s: towards citizen-driven research strategies in food and health
- Nivolumab wordt slechts in 3 van de 12 ziekenhuizen gegeven aan longkankerpatienten terwijl ze verplicht zijn dit wel te geven.
- Minister Schippers wil garantie van ziektekostenverzekeraars en ziekenhuizen voor dure medicijnen bij kanker.
- Nederland betaalt veel meer voor kankermedicijnen, soms tot 50 procent of meer, dan andere landen blijkt uit vergelijkend onderzoek tussen 18 landen
- Filmmaakster Meral Uslu heeft borstkanker en vertelt daarover in haar film Mijn Kanker die wordt uitgezonden op maandag 30 november 2015 op NPO 2
- Criminelen in gevangenissen en psychiatrische patiënten krijgen voedingssupplementen binnen onderzoeksverband met als doel hun gedrag positief te beïnvloeden.
- Denny van Brenk - 33 jaar - overleeft nu 1 jaar in lever uitgezaaide galwegenkanker door chemo pomp in New York, maar hij heeft alles zelf moeten betalen
- We vertrouwen de dokter blind maar de zorg voor geen meter. Sander Heijne van de Correspondent ging uit op onderzoek maar ook hij komt er niet uit. .
- Hoe kankerpatienten hoopvolle medicijnen en behandelingen wordt onthouden waardoor zelfs oncologen in opstand komen.
- Schaken met de dood: documentaire over nieuwste medicijnen tegen kanker binnen personalised medicine in het AvL - Anthonie van Leeuwenhoek ziekenhuis.
- Alpe d'HuZes geld blijft ongebruikt voor wetenschappelijk onderzoek. Coen van Veenendaal gerehabiliteerd door Medialogica en Volkskrant
- Meeste wetenchapsgeld komt terecht bij enkele toponderzoekers. 10 procent beschikt over meer dan 60 procent van al het geld voor vrij onderzoek in Nederland.
- Het grote bedrog van de farmaceutische industrie en de toezichthouders als de EMA blootgelegd door de Correspondent in mooi stuk onderzoeksjournalistiek
- 40 procent van door FDA gevonden fraude in klinische studies wordt niet gecorrigeerd en vermeld in uiteindelijke medicijnvoorschriften.
- Patiënt moet agenda kankeronderzoek bepalen, stelt Peter Kapitein in zijn nieuwe column
- Huub Schellekens, biofarmaceut aan universiteit van Utrecht, stelt dure medicijnen aan de kaak. Radioprogramma Argos volgde hem 2 jaar. Zeer onthullende reportage



Plaats een reactie ...
Reageer op "Is bacteriofaag de oplossing voor resistente bacterien waar antibiotica faalt? Antoinette Hertsenberg prijst deze aanpak aan in DWDD die al veel langer bekend is."